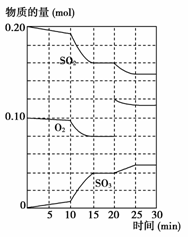
21.(10分)反应①Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+O2(g)===CO2(g) ΔH=b kJ·mol-1
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+O2(g)===CO2(g) ΔH=b kJ·mol-1
测得在不同温度下,K值如下:
|
温度(℃) |
500 |
700 |
900 |
|
K |
1.00 |
1.47 |
2.40 |
(1)若500 ℃时进行反应①,CO2起始浓度为2 mol·L-1,CO的平衡浓度为________。
(2)反应①中的a________0(填“>”、“<”或“=”)。
(3)700 ℃反应①达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有________(填序号)。
A.缩小反应器体积 B.通入CO2
C.升高温度到900 ℃ D.使用合适的催化剂
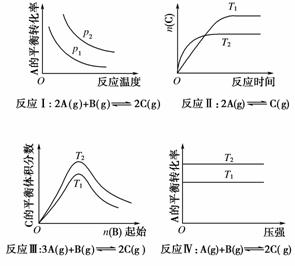
(4)下列图象符合反应①的是________(填序号)。
(图中v是速率,φ为混合物中CO含量,T为温度且T1>T2)
(5)由反应①和②可求得,反应2Fe(s)+O2(g)===2FeO(s)的ΔH=________。
[解析] (1)500 ℃时反应①的K=1,设CO的平衡浓度为c,则K==1,解得c=1 mol·L-1。(2)根据提供的数据可知,温度升高,反应①的K值增大,即平衡向正反应方向移动,故正反应为吸热反应,a大于0。(3)反应①中反应前后气体分子数不变,改变压强,平衡不移动,A错;通入CO2,平衡向右移动,B对;反应①为吸热反应,升高温度,平衡向右移动,C对;使用催化剂,平衡不移动,D错。(4)升高温度,正逆反应速率均增大,但平衡向右移动,正反应速率大于逆反应速率,A对;升高温度,平衡向右移动,CO的百分含量增大,B、C错。(5)根据盖斯定律,该反应可以通过①×2+②×2得到,故反应的ΔH=2(a+b) kJ·mol-1。
[答案] (1)1 mol·L-1 (2)> (3)BC (4)A
(5)2(a+b) kJ·mol-1
18.(14分)(2008年重庆理综)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是____________。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)
 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将________(填“增大”“减小”或“不变”)。
②下表为反应在T1温度下的部分实验数据:
|
t/s |
0 |
500 |
1 000 |
|
c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500 s内N2O5的分解速率为___________________________________。
③在T2温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2________T1。
(3)下图所示装置可用于制备N2O5,则N2O5在电解池的________区生成,其电极反应式为________________________________________________________________________
________________________________________________________________________。
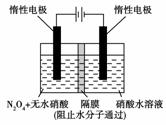
[解析] 本题涉及有机化学、化学反应速率、化学平衡、电化学等相关知识,注重考查学生分析和综合应用知识的能力。
(1)硝基苯结构简式的书写要注意键的连接和规范;
(2)①恒容充入不参与反应的氮气,反应混合物中各物质的浓度均不发生改变,故平衡不发生移动,N2O5的转化率不变;
②v(N2O5)=(5.00-3.52)mol·L-1÷500 s=0.002 96 mol·L-1·s-1;③在T1温度下,1 000 s时NO2的浓度为(5.00-2.48)mol·L-1×2=5.04 mol·L-1>4.98 mol·L-1,在前1 000 s内产生NO2的速率,T1时大于T2时,故T1>T2;
(3)由N2O4转化成N2O5时氮元素化合价由+4变为+5,失去了电子,故在阳极产生N2O5,电极反应方程式的书写要注意HNO3参加反应。
[答案] (1)  (2)①不变
(2)①不变
②0.002 96 mol·L-1·s-1 ③<或小于 (3)阳极
N2O4+2HNO3-2e-===2N2O5+2H+
17.(6分)某同学用0.1 mm×10 mm×25 mm质量分数大于或等于99.5%的铝片和酸反应制取H2,实验现象如下表:
|
时间 酸 |
1 min |
2 min |
5 min |
15 min |
20 min |
|
3 mol·L-1HCl |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5 mol·L-1H2SO4 |
均无明显现象(无气泡) |
(1)写出上述铝与酸反应的离子方程式__________________________________。
(2)反应1-15 min内,铝与盐酸的反应速率逐渐加快,其原因是________________________________________________________________________。
(3)为探究铝与盐酸反应比铝与硫酸反应快的原因,必须首先作出猜想,请提出你的猜想________________________________________________________________________
________________________________________________________________________。
[解析] (1)Al与稀HCl、稀H2SO4反应的离子方程式为2Al+6H+===2Al3++3H2↑。
(2)铝与盐酸反应属放热反应,随着溶液温度的升高,反应速率逐渐增大。
(3)3 mol·L-1 HCl与1.5 mol·L-1 H2SO4中c(H+)相同,铝与盐酸反应时,反应逐渐加快,而铝与H2SO4反应无明显现象,表明HCl中Cl-对Al与H+的反应起促进作用,而SO对Al与H+的反应起阻碍作用。
[答案] (1)2Al+6H+===2Al3++3H2↑
(2)Al与盐酸反应是放热反应,导致溶液温度升高,反应加快
(3)Cl-能促进Al与H+的反应,而SO抑制Al与H+的反应
 H++OH-。下列叙述正确的是
H++OH-。下列叙述正确的是
 2SO3(g);ΔH<0
2SO3(g);ΔH<0