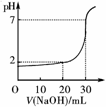
1.如右图所示为10 mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是
( )
|
|
A |
B |
C |
D |
|
|
0.12 |
0.04 |
0.03 |
0.09 |
|
|
0.04 |
0.12 |
0.09 |
0.03 |
[解析] 观察图知,当NaOH用至30 mL时已正好中和,根据c1V1=c2V2,V1∶V2=10∶30=1∶3,则c1∶c2=3∶1,故B、C选项被排除,但又由于加入NaOH 20 mL时,溶液pH已达到2,设HCl浓度为3x,则NaOH浓度为x。c(H+)===0.01 mol·L-1,x=0.03 mol·L-1,3x=0.09 mol·L-1。
[答案] D
 CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中和,所以消耗NaOH的体积不会变化。
CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中和,所以消耗NaOH的体积不会变化。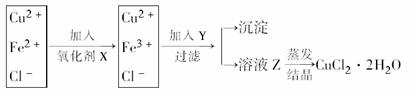

 Cu(OH)2+2H+,加入盐酸可起到抑制作用,并且在蒸发过程中要不断搅拌且不能蒸干。
Cu(OH)2+2H+,加入盐酸可起到抑制作用,并且在蒸发过程中要不断搅拌且不能蒸干。
 CH3COOH+OH-
CH3COOH+OH-
 CH3COO-+H+,当向CH3COOH的水溶液中加入含有CH3COO-的电解质时,同种离子对电离平衡的影响为主要因素,相反由于CH3COO-的水解较弱,则为次要因素。在CH3COOH的电离平衡体系中,加入CH3COONa晶体,电离出大量CH3COO-,抑制了CH3COOH的电离,使H+浓度减小,因此溶液的pH增大,这为主要影响因素,而CH3COO-的水解影响则为次要因素。要说明这一问题,可选CH3COONH4做试剂进行实验探究,因为CH3COONH4水解显中性,加入固体CH3COONH4后,测得CH3COOH溶液的pH增大,即pH>3,这说明CH3COOH的电离平衡向左移动了,使H+浓度减小了,故乙同学的解释正确
CH3COO-+H+,当向CH3COOH的水溶液中加入含有CH3COO-的电解质时,同种离子对电离平衡的影响为主要因素,相反由于CH3COO-的水解较弱,则为次要因素。在CH3COOH的电离平衡体系中,加入CH3COONa晶体,电离出大量CH3COO-,抑制了CH3COOH的电离,使H+浓度减小,因此溶液的pH增大,这为主要影响因素,而CH3COO-的水解影响则为次要因素。要说明这一问题,可选CH3COONH4做试剂进行实验探究,因为CH3COONH4水解显中性,加入固体CH3COONH4后,测得CH3COOH溶液的pH增大,即pH>3,这说明CH3COOH的电离平衡向左移动了,使H+浓度减小了,故乙同学的解释正确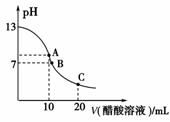

 HA+OH-,故A正确,由电荷守恒得C正确。
HA+OH-,故A正确,由电荷守恒得C正确。