3.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
|
选项 |
操作及现象 |
溶液 |
|
A |
通入CO2,溶液变浑浊。再升温至65
℃以上,溶液变澄清 |
C6H5ONa 溶液 |
|
B |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失 |
Na2SiO3 溶液 |
|
C |
通入CO2,溶液变浑浊。再加入品红溶液,红色褪去 |
Ca(ClO)2 溶液 |
|
D |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊 |
Ca(OH)2 溶液 |
[解析] A项,CO2+C6H5ONa―→C6H5OH+NaHCO3,升温至65 ℃以上,C6H5OH完全溶解,溶液变澄清。B项,CO2+Na2SiO3+H2O===Na2CO3+H2SiO3↓,H4SiO4与CO2不反应,浑浊不会消失。C项,CO2+Ca(ClO)2+H2O===CaCO3↓+2HClO,所以溶液变浑浊。加入品红,被HClO氧化褪色。D项,首先,CO2+Ca(OH)2===CaCO3↓+H2O,继续通CO2,产生可溶于水的Ca(HCO3)2,再加入足量的NaOH,则:2NaOH+Ca(HCO3)2===CaCO3↓+Na2CO3+2H2O,溶液又变浑浊。
[答案] B
10.(2007年广东)下述实验能达到预期目的的是
( )
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有氧化性 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯与溴的氧化性强弱 |
|
C |
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 |
研究温度对化学平衡的影响 |
|
D |
分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对H2O2分解速率的影响 |
[解析] A项在该反应中,SO2体现还原性;D项两种溶液浓度不同,H2O2分解速率不同,到底是催化剂还是浓度的影响说不清楚。
[答案] BC


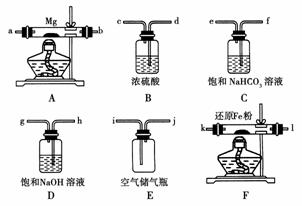
 △,2MgO;②3Mg+N2
△,2MgO;②3Mg+N2