网址:http://m.1010jiajiao.com/timu3_id_88189[举报]
(1)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0,
P(g)+Q(g) ΔH>0,
若要增大Q的浓度,在其它条件不变的情况下可以采取的措施为 (填序号)。
A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________ 。
(3)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
得CO2和CH3OH(g)的浓度随时间变化如右图所示。
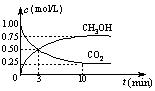
①从3 min到10 min,v(H2)= mol/(L·min)。
②能说明上述反应达到平衡状态的是 (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号)。
A.升高温度 B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入1 mol CO2和3 mol H2
查看习题详情和答案>> (1)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0,
P(g)+Q(g) ΔH>0,
若要增大Q的浓度,在其它条件不变的情况下可以采取的措施为 (填序号)。
A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________ 。
(3)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
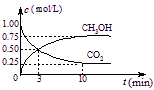 得CO2和CH3OH(g)的浓度随时间变化如右图所示。
得CO2和CH3OH(g)的浓度随时间变化如右图所示。
①从3 min到10 min,v(H2)= mol/(L·min)。
②能说明上述反应达到平衡状态的是 (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号)。
A.升高温度 B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入1 mol CO2和3 mol H2
查看习题详情和答案>>据新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的汽化和液化可以提高燃料的利用率。
已知25℃,101kPa时:C(s) +1/2O2(g)=CO(g) ΔH= -126.4 kJ·mol-1
2H2(g) +O2(g)=2H2O(l) ΔH= -571.6 kJ·mol-1 H2O(g)= H2O(l) ΔH= -44 kJ·mol-1
则在25℃,101kPa时:C(s) + H2O(g)= CO(g) + H2(g) ΔH=____________________。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) ![]() Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该平衡_______移动(填“向左”、“向右”或“不”),判断依据是
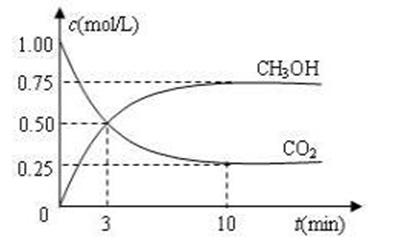
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
|
 | ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
|
| |||||||||||||
| ||||||||||||||
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②下列措施能使![]() 增大的是________(填符号)。
增大的是________(填符号)。
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大
查看习题详情和答案>>已知反应①Fe(s)+CO2(g)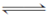 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2. 40 |
(2)反应①为________(选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡,要使该平衡向右移动且能增大CO2(g)的转化率,其他条件不变时,可以采取的措施有________(填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到900 ℃
D.使用合适的催化剂 E.增加Fe的量
(4)下列能说明反应②达到平衡状态的是________。
a.每消耗1 molCO的同时生成1 mol CO2 b.体系压强保持不变
c.v正(O2)=v逆(CO2) d.容器中混合气体的密度保持不变
e.混合气体中CO的体积分数保持不变 f.CO和O2的体积比保持不变 查看习题详情和答案>>
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2. 40 |
(2)反应①为________(选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡,要使该平衡向右移动且能增大CO2(g)的转化率,其他条件不变时,可以采取的措施有________(填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到900 ℃
D.使用合适的催化剂 E.增加Fe的量
(4)下列能说明反应②达到平衡状态的是________。
a.每消耗1 molCO的同时生成1 mol CO2 b.体系压强保持不变
c.v正(O2)=v逆(CO2) d.容器中混合气体的密度保持不变
e.混合气体中CO的体积分数保持不变 f.CO和O2的体积比保持不变