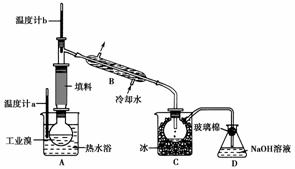
18.(10分)实验室用浓盐酸和MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉,现已知反应:
2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O
温度稍高即发生副反应:
6Cl2+6Ca(OH)2===Ca(ClO3)2+5CaCl2+6H2O
现有三个同学分别设计的三套实验装置,如下图所示:
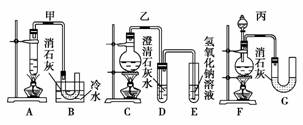
(1)请从a.不容易控制反应速率,b.容易控制反应速率,c.有副反应发生,d.可防止副反应发生,e.污染环境,f.可防止污染环境几个方面对上述甲、乙、丙三套装置的优、缺点作出评析,并选择符合题目要求的选项填在空格内。
|
|
优点 |
缺点 |
|
甲装置 |
|
|
|
乙装置 |
|
|
|
丙装置 |
|
|
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中选取合理的组成部分,组装一套较完善的实验装置,装置各部分的连接顺序(按气流从左到右的方向)是______。
(3)实验中若用12 mol·L-1的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是____________0.15 mol(填“大于”“小于”或“等于”),其原因是(假定各步反应均无反应物损耗,且无副反应发生) ____________________________________________
________________________________________________________________________。
[答案] (1)甲:d ae 乙:f ac 丙:b ce
(2)F-B-E
(3)小于 随反应进行,盐酸浓度小到一定程度后不再与MnO2作用,产生的氯气小于0.3 mol,最终生成的Ca(ClO)2也就小于0.15 mol

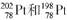 的说法正确的是 ( )
的说法正确的是 ( )