摘要:19.在一定条件下.二氧化硫和氧气发生如下反应: 2SO2(g)+O2(g)2SO3(g),ΔH<0 (1)降低温度.二氧化硫转化率 .化学反应速率 (以上均填增大.减小或不变). (2)600 ℃时.在一密闭容器中.将二氧化硫和氧气混合.反应过程中SO2.O2.SO3物质的量变化如上图所示.反应处于平衡状态的时间是 . (3)据图判断.反应进行至20 min时.曲线发生变化的原因是 . 10 min到15 min的曲线变化的原因可能是 . a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量 [解析] (1)降低温度.平衡向正反应方向移动.反应物浓度减小生成物浓度增大.故二氧化硫转化率增大.但化学反应速率随温度降低而减小. (2)由图示知:0-15 min时.反应物SO2和O2的量均逐渐减少.生成物SO3的量逐渐增多.15-20 min时.反应物和生成物的量均保持不变.说明反应处于平衡状态. (3)反应进行到20 min时氧气物质的量突然增多为0.12 mol.而SO2和SO3的物质的量仍与平衡时一致.说明此时增加了O2的量.10 min到15 min的曲线变化说明反应速率大幅增大.可能的原因是a.加了催化剂.b.增大压强.缩小容器体积.由于降温反应速率减小.不可能是c.SO3的物质的量没有突然增多且平衡时SO2和SO3物质的量之和仍为0.20 mol.故d选项不正确. [答案] 15-20 min和25-30 min (3)增加了O2的量 ab
网址:http://m.1010jiajiao.com/timu3_id_88187[举报]
 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)(1)写出该反应的化学平衡常数表达式 K=
| [SO3]2 |
| [SO2]2[O2] |
| [SO3]2 |
| [SO2]2[O2] |
(2)降低温度,该反应K值
增大
增大
,二氧化硫转化率增大
增大
,化学反应速度减小
减小
(以上均填增大、减小或不变)(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于第一次平衡状态的时间是
15-20min
15-20min
.(4)据图判断,反应进行至20min时,曲线发生变化的原因是
增大了氧气的浓度
增大了氧气的浓度
(用文字表达),10-15min的曲线变化的原因能是ab
ab
(填写编号)a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量.
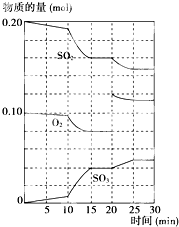 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0(1)降低温度,该反应K值
增大
增大
,二氧化硫转化率增大
增大
,化学反应速率减小
减小
.(以上均填“增大”“减小”或“不变”)(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间有
15-20min、25-30min
15-20min、25-30min
.(3)据上图判断,反应进行至20min时,曲线发生变化的原因是
增大氧气的浓度
增大氧气的浓度
(用文字表达);10min到15min的曲线变化的原因可能是ab
ab
(填写编号).a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量.
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值
(3)已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度…今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐→较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:①HA+HC2-(少量)=A-+H2C-②H2B(少量)+2A-=B2-+2HA③H2B(少量)+H2C-=HB-+H3C
回答下列问题:
①相同条件下,HA、H2B、H3C三种酸中酸性最强的是
②判断下列反应的离子方程式中正确的是(填写标号)
A.H3C+3A-=3HA+C3-B.HB-+A-=HA+B2-C.H3C+B2-=HB-+H2C-
③A-、B2-、C3-、HB-、H2C-、HC2- 6种离子中,最易结合质子的是
查看习题详情和答案>>
(1)写出该反应的化学平衡常数表达式K=
| c2(SO3) |
| c2(SO2)×c(O2) |
| c2(SO3) |
| c2(SO2)×c(O2) |
(2)降低温度,该反应K值
增大
增大
,二氧化硫转化率增大
增大
,化学反应速度减小
减小
(以上均填增大、减小或不变)(3)已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度…今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐→较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:①HA+HC2-(少量)=A-+H2C-②H2B(少量)+2A-=B2-+2HA③H2B(少量)+H2C-=HB-+H3C
回答下列问题:
①相同条件下,HA、H2B、H3C三种酸中酸性最强的是
H2B
H2B
.②判断下列反应的离子方程式中正确的是(填写标号)
BC
BC
.A.H3C+3A-=3HA+C3-B.HB-+A-=HA+B2-C.H3C+B2-=HB-+H2C-
③A-、B2-、C3-、HB-、H2C-、HC2- 6种离子中,最易结合质子的是
C3-
C3-
,最难结合质子的是HB-
HB-
. 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0(1)写出该反应的化学平衡常数表达式K=
| [SO3]2 |
| [SO2]2[O2] |
| [SO3]2 |
| [SO2]2[O2] |
(2)降低温度,该反应K值
增大
增大
(填“增大、减小或不变”)(3)在600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是
15-20min
15-20min
和25-30min.(4)在第一次平衡状态时,SO2的转化率是
20%
20%
.(5)在600℃时,测得某混合体系中各物质的浓度为:c(SO2)=0.1mol/L,c(O2)=0.5mol/L,c(SO3)=0.2mol/L.通过计算,判断此混合体系中反应进行的方向.要求写出具体的计算过程.
在一定条件下,二氧化硫和氧气发生如下反应:?
2SO2(g)+ O2(g) ![]() 2SO3(g) ;ΔH<0?
2SO3(g) ;ΔH<0?
(1)写出该反应的化学平衡常数表达式K= 。?
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 。(以上均填增大、减小或不变)?
(3)

(4)据图判断,反应进行至20 min时,曲线发生变化的原因是 (用文字表达);10 min到15 min的曲线变化的原因可能是? ? (填写编号)。?
A.加了催化剂
B.缩小容器体积?
C.降低温度
D.增加SO3的物质的量
查看习题详情和答案>>