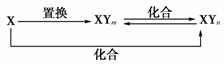
13.铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为_________________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是____________________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是____________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是________________________________________________________________________。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是____________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对;有 |
|
B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁得到铁 |
Ⅰ对;Ⅱ对;无 |
|
C |
铁属于过渡元素 |
铁和铁的某些化合物可用作催化剂 |
Ⅰ错;Ⅱ对;无 |
|
D |
在空气中铁的表面能形成致密的氧化膜 |
铁不能与氧气反应 |
Ⅰ对;Ⅱ对;有 |
[解析] (1)钢铁在空气中发生吸氧腐蚀时,正极发生的电极反应为:O2+2H2O+4e-===4OH-。
(2)Fe3+氧化Cu而腐蚀印刷电路铜板:2Fe3++Cu===2Fe2++Cu2+。
(3)Fe3+水解产生具有吸附作用的Fe(OH)3胶体而净水:Fe3++3H2OFe(OH)3(胶体)+3H+,在酸性条件下,由于H+抑制了Fe3+的水解,无法产生Fe(OH)3胶体,故不能使悬浮物沉降除去。
(4)1 mol Fe3O4参与反应时,需4 mol CO,根据4 mol CO可得转移8 mol电子,所以1.5 mol Fe3O4参加反应时转移电子的物质的量为1.5×8 mol=12 mol。
(5)选项A,地壳中含量最高的金属元素Al元素,而不是Fe元素,由于铁是活泼金属,需通过冶炼方法获得,所以Fe不是人类最早使用的金属材料,陈述Ⅰ、Ⅱ错误,且二者没有因果关系。选项B,Fe能与稀H2SO4发生置换反应而产生H2,但在高温条件下,H2还原性很强,又能还原Fe2O3而得Fe,所以Ⅰ、Ⅱ均正确,二者无因果关系。选项C,铁是过渡元素的说法正确。选项D,铁在空气中不能形成致密的氧化膜,且Fe可与纯净的O2反应生成Fe3O4。
[答案] (1)O2+2H2O+4e-===4OH-
(2)2Fe3++Cu===2Fe2++Cu2+
(3)Fe3++3H2OFe(OH)3(胶体)+3H+ 酸性环境中,H+抑制了铁离子的水解,无法生成氢氧化铁胶体
(4)12 mol (5)B
8.下列各组物质,不能按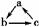 (“→”表示反应一步完成)关系转化的是
(“→”表示反应一步完成)关系转化的是
( )
|
选项 |
a |
b |
c |
|
A |
Al2O3 |
NaAlO2 |
Al(OH)3 |
|
B |
NO |
NO2 |
HNO3 |
|
C |
FeCl2 |
Fe(OH)2 |
Fe(OH)3 |
|
D |
CH2===CH2 |
CH2BrCH2Br |
CH CH CH |
[解析] Fe(OH)3无法一步生成FeCl2。
[答案] C

 (3)在右图中画出溶液中Fe2+、NO离子的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。
(3)在右图中画出溶液中Fe2+、NO离子的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。