5.将煤转化为水煤气的方法是通过化学高温方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要反应为:C+H2O(g)CO+H2.有关物质的燃烧热数据如下表所示:
|
物质 |
C |
H2 |
CO |
|
ΔH/kJ·mol-1 |
-393.5 |
-285.8 |
-283.0 |
已知:1 mol H2O(g)转化为1 mol H2O(l)放出44.0 kJ的热量.回答下列问题:
(1)写出C完全燃烧的热化学方程式:_________________________________________.
(2)写出煤转化为水煤气的主要反应的热化学方程式:
________________________________________________________________________
________________________________________________________________________.
(3)现以H2或CO为燃料来提供热能,你认为应该选择________,理由是__________
________________________________________________________________________
________________________________ ________________________________________.
________________________________________.
解析:(1)由表格中C的燃烧热的数据可书写出C完全燃烧生成CO2的热化学方程式.
(2)依据C、H2、CO的燃烧热,书写热化学方程式.
①C(s)+O2(g)===CO2(g);ΔH1=-393.5 kJ·mol-1
②H2(g)+O2(g)===H2O(l);
ΔH2=-285.8 kJ·mol-1
③CO(g)+O2(g)===CO2(g);
ΔH3=-283.0 kJ·mol-1
④H2O(g)===H2O(l);ΔH4=-44 kJ·mol-1
由①-②-③+④得
C(s)+H2O(g)===CO(g)+H2(g);
ΔH=ΔH1-ΔH2-ΔH3+ΔH4
=-393.5 kJ·mol-1-(-285.8 kJ·mol-1)-(-283.0 kJ·mol-1)+(-44 kJ·mol-1)=
+ 131.3
kJ·mol-1
131.3
kJ·mol-1
(3)此小题为开放性试题,可以从等质量H2和CO完全燃烧放热多少的角度选择H2,也可以从生产成本的角度选择CO.
答案:(1)C(s)+O2(g)===CO2(g);
ΔH=-393.5 kJ·mol-1
(2)C(s)+H2O(g)===CO(g)+H2(g);
ΔH=+131.3 kJ·mol-1
(3)H2 等质量的H2完全燃烧放出的热量比CO多,且H2的燃烧产物为H2O,对环境无影响
CO 生产H2的成本比生产CO的成本高
14.(10分)通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能.已知部分化学键的键能如下:
|
化学键 |
N-H |
N-N |
O==O |
N N N |
O-H |
|
键能(kJ/mol) |
386 |
167 |
498 |
946 |
460 |
(1)发射神舟飞船的长征火箭用了肼(N2H4,气态)为燃料,若它在氧气(气态)中燃烧,生成N2(气态)和H2O(液态).1 mol肼完全燃烧时放出的热量为________.
(2)为了提高肼(N2H4)燃烧过程中释放的能量,常用二氧化氮作氧化剂代替氧气,这两者反应生成氮气和水蒸气.且:
①N2(g)+2O2(g)===2NO2(g);ΔH1=+67.7 kJ/mol
②N2H4(g)+O2(g)===N2(g)+2H2O(g);ΔH2=-534 kJ/mol
试写出肼和NO2完全反应的热化学方程式:____________________________________
________________________________________________________________________.
解析:(1)根据题意,肼燃烧时发生反应为N2H4(g)+O2(g)===N2(g)+2H2O(l);故ΔH=[(386×4+167)+498]-(946+2×2×460)=-577 kJ/mol,即1 mol肼完全燃烧时放出的热量为577 kJ.
(2)根据题意,要求计算下列反应的反应热:③N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g);ΔH3.根据盖斯定律,一个反应的反应热的大小仅与其始态和终态有关,而与其过程无关,则存在:③=②-①÷2,即:ΔH3=ΔH2-ΔH1÷2=-567.85 kJ/mol.
答案:(1)577 kJ
(2)N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g);ΔH3=-567.85 kJ/mol

12.(18分)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液进行中和热的测定.
Ⅰ.配制0.50 mol/L NaOH溶液
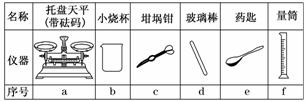
(1)若实验中大约要使用245 mL NaOH溶液,则至少需要称量NaOH固体________g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)________.
Ⅱ.测定中和热的实验装置如图所示
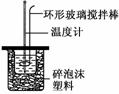
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol):
________________________________________________________________________.
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表.
①请填写下表中的空白:
|
温度 实验 次数 |
起始温度t1/℃ |
终止温度t2/℃ |
平均温度差(t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
|
2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃).则中和热ΔH=________(取小数点后一位).
③上述实验结果的数值与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
解析:Ⅱ.(1)根据中和热定义和热化学方程式的书写原则可得:H2SO4(aq)+NaOH(aq)===Na2SO4(aq)+H2O(l);ΔH=-57.3 kJ/mol.
(2)1、2、3、4次实验的温度差分别为4.0℃、6.1℃、3.9℃、4.1℃,与其他三组数据相比,6.1℃较大,舍去.其余三次温度差的平均值为4.0℃.0.5 mol/L H2SO4(aq)和0.5 mol/L NaOH(aq)的密度为1 g/cm3,故m(H2SO4)=ρ(H2SO4)·V(H2SO4)=1 g/mL×30 mL=30 g,m(NaOH)=ρ(NaOH)·V(NaOH)=1 g/mL×50 mL=50 g.中和后生成的溶液为稀溶液,其比热容c=4.18 J/(g·℃),由此可以计算出30 mL H2SO4(aq)和50 mL NaOH(aq)发生反应时放出的热量为:Q放=[m(NaOH)+m(H2SO4)]·c·(t2-t1),中和热为生成1 mol H2O(l)时放出的热量,ΔH=-×10-3 kJ/mol=-53.5 kJ/mol.
答案:Ⅰ.(1)5.0 (2)abe Ⅱ.(1)H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l);ΔH=-57.3 kJ/mol
(2)①4.0 ②-53.5 kJ/mol ③acd

 2NH3(g) ΔH=-92.4 kJ/mol,在该条件下,下列叙述正确的是( )
2NH3(g) ΔH=-92.4 kJ/mol,在该条件下,下列叙述正确的是( )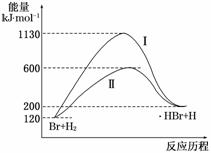
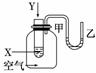 某学生用如图所示装置进行化学反应X+2Y===2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到试管中甲处下降,乙处上升.关于该反应的下列叙述正确的是( )
某学生用如图所示装置进行化学反应X+2Y===2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到试管中甲处下降,乙处上升.关于该反应的下列叙述正确的是( )
 ____(填“能”或“不能”)改变该反应的反应热.
____(填“能”或“不能”)改变该反应的反应热. __________________________________________.
__________________________________________.