2.(2010·湘潭模拟)几种短周期元素的原子半径及主要化合价见下表:
|
元素符号 |
K |
L |
M |
Q |
R |
T |
N |
|
原子半径/nm |
0.186 |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
0.152 |
|
主要化合价 |
+1 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
+1 |
下列叙述正确的是( )
A.K、L、M三种元素单质的还原性逐渐增强
B.在RCl2分子中,各原子最外层均满足8电子的稳定结构
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中有共价键
解析:由元素的主要化合价结合原子半径知T是氧元素、Q是硫元素、K是钠元素、L是镁元素、M是铝元素、N是锂元素、R是铍元素.钠、镁、铝的还原性逐渐减弱,A项错;BeCl2中,铍最外层只有4个电子,B项错;SO3是非电解质,C项错;钠燃烧生成的Na2O2中,氧原子之间存在共价键.
答案:D
11.(9分)已知A、B、C、D、E、F均为短周期主族元素,原子序数依次增大,它们的原子半径和最高正化合价或最低负化合价如下表所示:
|
元素 |
A |
B |
C |
D |
E |
F |
|
原子半径(nm) |
0.152 |
0.077 |
0.071 |
0.186 |
0.110 |
0.102 |
最高正化合价或最低负 化合价 化合价 |
+1 |
+4 -4 |
-1 |
+1 |
+5 -3 |
+6 -2 |
(1)写元素符号:A________,D________,F________.
(2)A的单质可以在常温下与氮气反应,写出反应的化学方程式:___________________,产物的化学键类型为___________________.
(3)写出D与F形成的化合物水解的离子方程式:_________________________________.
解析:根据所有元素均为短周期元素,A、D均为+1价,A的半径小于D,但A的半径不是表格中最小的,故A为Li元素,D为Na元素,由F的化合价判断其为S元素;由B、E的化合价和半径推出B为C元素,E为P元素,最后根据化合价和半径推出C为F元素.
答案:(1)Li Na S
(2)6Li+N2===2Li3N 离子键
(3)S2-+H2O HS-+OH-
HS-+OH-
 A.甲烷 B.金刚石
A.甲烷 B.金刚石
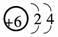 答案:(1)
O===C===O
答案:(1)
O===C===O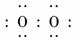 答案:(1)氧元素 钠元素 铝元素
答案:(1)氧元素 钠元素 铝元素 答案:A
答案:A