22.(10分)某研究性学习小组在网上收集到如下信息:Fe(NO 3)3溶液可以蚀刻银,制作美丽的银饰.他们对蚀刻银的原因进行了如下探究:
3)3溶液可以蚀刻银,制作美丽的银饰.他们对蚀刻银的原因进行了如下探究:
[实验]
制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解.
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag.
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO能氧化Ag.
[设计实验方案,验证假设]
(1)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立.请写出Fe3+氧化Ag的离子方程式:_____________________________________________________________
________________________________________________________________________.
(2)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO在不同条件下的还原产物较复杂,有时难以观察到气体产生).
|
实验步骤(不要求写具体操作过程) |
预期现象和结论 |
|
① ② …… |
若银镜消失,假设2成立. 若银镜不消失,假设2不成立. |
[思考与交流]
(3)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO都氧化了Ag.
你是否同意丙同学的结论,并简述理由:_______________________________________
________________________________________________________________________.
解析:(2)Fe3+氧化Ag生成Fe2+和Ag+;(3)可用Fe(NO3)3溶液和稀硝酸做对比实验进行验证;(4)丙同学没有检验NO的还原产物,故不能得出题述结论.
答案:(1)Ag+Fe3+===Ag++Fe2+
(2)
|
实验步骤(不要求写具体操作过程) |
预期现象和结论 |
|
①
测定上述实验用的Fe(NO3)3溶液的pH ②配制相同pH的稀硝酸溶液,将此溶液加入有银镜的试管内 |
|
(3)不同意.甲同学检验出了Fe2+,可确定Fe3+一定氧化了Ag;乙同学虽然验证了此条件下NO能氧化Ag,但在硝酸铁溶液氧化Ag时,由于没有检验NO的还原产物,因此不能确定NO是否氧化了Ag(答案合理均可).
 TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.
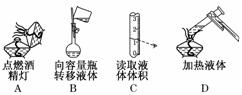
TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用. 的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号).
的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号).
 配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________.
配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________. TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
 导致所用KMnO4溶液体积偏大.
导致所用KMnO4溶液体积偏大.