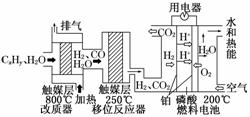
22.(10分)(2010·长安一中、高新一中、交大附中、师大附中、西安中学第二次模拟考试)A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
|
阳离子 |
Ag+ Na+ |
 阴离子 阴离子 |
NO SO Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中C电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系图如下.据此回答下列问题:
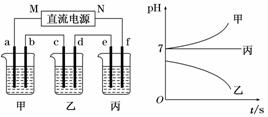
(1)M为电源的________极(填写“正”或“负”),甲________(填写化学式).
(2)计算电极f上生成的气体在标准状况下的体积________________________________.
(3)写出乙烧杯的电解池反应_________________________________________________.
(4)若电解后甲溶液的体积为25 L,则该溶液的pH为________________________.
(5)要使丙恢复到原来的状态,应加入________ g ________.(填写化学式)
解析:接通电源,经过一段时间后,测得乙中C电极质量增加了27克,说明乙中溶质是硝酸银,Ag++e- =Ag,得到27克Ag,电路中通过的电子是0.25 mol.
结合图可知甲的pH增大是氯化钠,丙的pH不变是硫酸钠.电极f上生成的气体是O2, 0.25 mol 电子可电解水2.25 g,产生0.0625 mol O2.
答案:(1)负 NaCl (2)1.4 L (3) 4AgNO3+2H2O通电4Ag+O2↑+4HNO3
19.(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c1 |
0.2 |
pH=7 |
|
丙 |
0.1 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:
________________________________________________________________________
__________ ________________________________
________________________________ ______________________________.
______________________________.
(2)不考虑其他组的实验结果,单从乙组情况分析,c1________等于0.2 mol·L-1(“一定”或“不一定”).混合溶液中离子浓度c(A-)与c(Na+)的大小关系是________(填字母序号).
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是________酸(“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是____________________________________________.
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________ mol·L-1.写出该混合溶液中c(Na+)-c(A-)=________ mol·L-1的精确结果(不能做近似计算,回答准确值,结果不一定要化简).
解析:(1)甲组中HA和NaOH恰好完全反应,根据NaA是否发生水解来判断HA是否为弱酸.
(2)乙组中,若HA为强酸,则c1=0.2 mol·L-1,若HA为弱酸,则c1>0.2 mol·L-1.由pH=7,c(H+)=c(OH-),根据溶液电荷守恒知c(A-)=c(Na+).
(3)丙组HA与NaOH恰好完全反应,反应后NaA溶液的pH>7,则说明NaA为强碱弱酸盐,HA为弱酸.
(4)丁组中HA与NaOH恰好完全反应,NaA溶液的pH=9,A-水解促进水的电离,OH-来自于水的电离,则c(H+)水=c(OH-)水=1×10-5 mol·L-1,由电荷守恒知,c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)-c(A-)=c(OH-)-c(H+)=1.0×10-5 mol·L-1-1.0×10-9 mol·L-1.
答案:(1)a=7时,HA是强酸,a>7时,HA为弱酸
(2)不一定 C
(3)弱 c(Na+)>c(A-)>c(OH-)>c(H+)
(4)1.0×10-5 10-5-10-9

 确的是( )
确的是( )
 2C(g)+2D(g);ΔH=Q,2 min末达到平衡,生成0.8 mol D.
2C(g)+2D(g);ΔH=Q,2 min末达到平衡,生成0.8 mol D.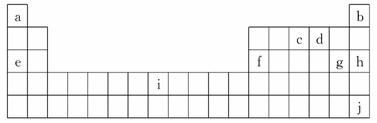
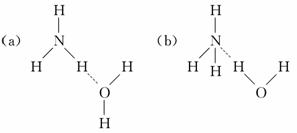
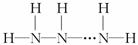 可以看出氢化物的通式为NnHn+2.
可以看出氢化物的通式为NnHn+2. D是Na、E是S,甲是甲醛、乙是乙烯、丙丁分别是硫酸氢钠和亚硫酸氢钠.
D是Na、E是S,甲是甲醛、乙是乙烯、丙丁分别是硫酸氢钠和亚硫酸氢钠.