15.(2009·南通)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
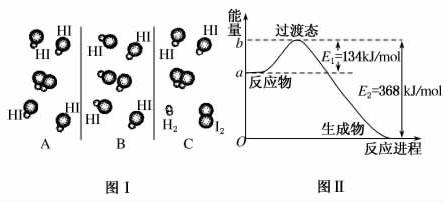
(1)图Ⅰ是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是________(选填“A”、“B”或“C”)。
(2)20世纪30年代Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程
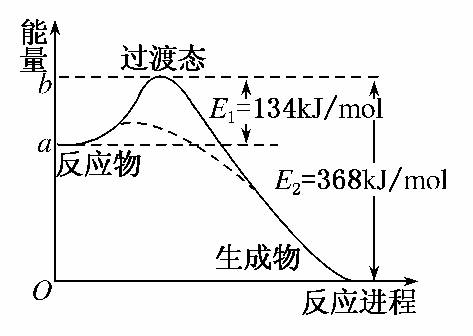
中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:____________________________________。
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图。
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键所需吸收的能量,下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O===O |
P===O |
|
键能/kJ·mol-1 |
197 |
360 |
499 |
x |
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中x=________。
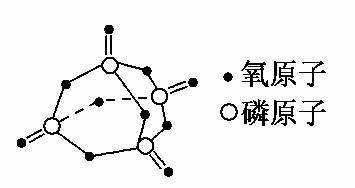
图Ⅲ
解析:(1)有效碰撞是发生化学反应的碰撞,即有新物质生成的碰撞,显然选C。(2)当反应物的总能量大于生成物的总能量时,反应放热,反之吸热,注意热化学方程式必须标明反应物和生成物的状态。(3)催化剂主要使有效碰撞的能量降低,使反应的门槛降低,即过渡态时的能量较低。
(4)P4+5O2===P4O10,燃烧热为(4x+12×360)-(6×197+5×499)=2378.0,求得x=433.75 kJ/mol。
答案:(1)C (2)NO2(g)+CO(g)===CO2(g)+NO(g);
ΔH=-234 kJ/mol
(3)上图虚线所示
(4)433.75
11.(2010·桂林市摸底考试)在一定条件下发生化学反应:2SO2(g)+O2(g)2SO3(g);ΔH=-197 kJ/mol。现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入气体的量和反应放出的热量(Q)如下表所示:
|
容器 |
SO2(mol) |
O2(mol) |
N2(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述不正确的是( )
A.在上述条件下反应生成1 mol SO3气体放热98.5 kJ
B. 在上述条件下将2 mol SO2与1 mol O2混合充分反应后放出的热量小于197 kJ
C. Q1=2Q2=2Q3=197 kJ
D. 2Q2=2Q3<Q1<197 kJ
解析:由方程式知,每生成2 mol SO3放出197 kJ热量,A对;恒容条件下,加入的N2对平衡移动不产生影响,故乙、丙容器达到平衡时放出的热量相同;甲、乙相比,平衡时若SO2的转化率相同,则2Q2=Q1,但因乙容器中压强比甲小,不利于反应向右进行,导致乙容器中SO2的转化率比甲容器中的小,故有2Q2<Q1,D对C错。
答案:C
