1.(2010·南昌模拟)图表归纳是学习化学的一种常用科学方法,某同学做出了如图所示的归纳,下列对应正确的是( )
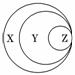
|
选项 |
X |
Y |
Z |
|
A |
胶体 |
混合物 |
淀粉溶液 |
|
B |
化合物 |
碱性氧化物 |
过氧化钠 |
|
C |
气态氢化物 |
化合物 |
甲 烷 烷 |
|
D |
强电解质 |
强酸 |
硫酸 |
解析:胶体是混合物中的一种,A错误;Na2O2不属于碱性氧化物,B错误;气态氢化物是化合物中的一种,C错误.
答案:D
 的热化学方程式是:C(s)+H2O(g)===CO(g)+H2(g) ΔH=________
kJ/mol.
的热化学方程式是:C(s)+H2O(g)===CO(g)+H2(g) ΔH=________
kJ/mol. :(1)根据提供信息,1 mol甲烷完全燃烧生成液态水放出890.31 kJ的热量,因此其热化学方程式为:CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.31
kJ/mol.
:(1)根据提供信息,1 mol甲烷完全燃烧生成液态水放出890.31 kJ的热量,因此其热化学方程式为:CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.31
kJ/mol.
 __________________________________________.
__________________________________________.