网址:http://m.1010jiajiao.com/timu3_id_84927[举报]
A.Q2=![]() B.Q2<
B.Q2<![]() C.Q2<Q1<197 kJ D.Q1=Q2=197 kJ
C.Q2<Q1<197 kJ D.Q1=Q2=197 kJ
298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g) 2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
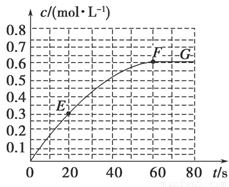
试回答下列问题。
(1)已知298 K时60 s达到平衡,比较40~60 s内和60~80s内B的平均反应速率:v(40~60) v(60~80)(填“﹥”或“﹦”或“﹤”)。
(2)若298 K达到平衡时,B的平衡浓度为A的3倍,共放出热量x kJ,开始加入A的物质的量是 mol。
(3)298k时,该反应的平衡常数为 mol/L。
(4)若反应在298 K进行,在1 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时共吸收热量y kJ,此时B的转化率为 (填序号)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之间
(5)结合(2)、(4)相关数据,写出a、x、y三者的等式关系式: 。
(6)若反应在298K进行,反应起始浓度为c(A)=c(B)=1.0mol/L,则化学平衡将 (填“正向”“逆向”或“不”)移动。
(7)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义是 。
查看习题详情和答案>>
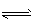 2B(g) △H=a kJ . mol-1。其中B的物质的量浓度随时间变化如图所示:
2B(g) △H=a kJ . mol-1。其中B的物质的量浓度随时间变化如图所示: 
(1)已知298 K时60 s达到平衡,则前60 s内A的平均反应速率为____ mol/(L·s)。
(2)该反应平衡常数的数学表达式为____。
(3)若298 K时B的平衡浓度为A的3倍,323 K时(其他条件不变),B的平衡浓度为A的2倍,且达到平衡所需时间为298 K时的
①该反应中 △H___0(填“>”或“<”)。
②请在上图中画出323 K时A的物质的量浓度随时间的变化曲线。
(4)若反应在298 K进行,在1L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时B的转化率为____。
A.等于60%
B.等于40%
C.小于40%
D.介于40%~60%之间
(5)已知曲线上任意两点之间连线的斜率表示该时段内B的平均反应速率(例如直线EF的斜率表示20~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义____。
(8分)德国人哈伯在1913年实现了合成氨的工业化生产,反应原理:
N2(g)+3H2(g)  2NH3(g);已知298 K时,
2NH3(g);已知298 K时,
ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1,试回答下列问题:
(1)计算说明298 K下合成氨反应能否自发进行?________(填“能”或“不能”);在298 K时,将10 mol N2和30 mol H2放入合成塔中,为什么放出的热量小于924 kJ?________。

(2)如图在一定条件下,将1 mol N2和3 mol H2混合于一个10 L的密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答下列问题:
①N2的转化率为________;
②在达到状态A时,平衡常数KA=________(代入数值的表达式,不要求得具体数值),当温度由T1变化到T2时,KA________KB(填“=”、“<”或“>”)。
③在达到状态B时,下列说法正确的是( )
a.通入氩气使压强增大,化学平衡向正反应方向移动
b.N2的正反应速率是H2的逆反应速率的1/3倍
c.降低温度,混合气体的平均相对分子质量变小
d.增加N2的物质的量,H2的转化率降低
(3)若在恒温、恒压条件下合成氨反应达到平衡后,再向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”)。
(4)在1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温高压下高转化率的电化学合成氨,其实验装置如图:

则阴极的电极反应式为____________________________________________________。
查看习题详情和答案>>
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。

请回答下列问题:
(1)X元素在周期表中的位置是第__________周期第___________族。
(2)下图是实验室模拟工业法合成C的简易装置。简述检验有C生成的方法_____________。

(3)在298 K时,Y(g)+3Z(g) ![]() 2C(g) ;ΔH=-92.4 kJ·mol-1,将Y、Z两种单质按物质的量比1∶3充入一密闭容器中。问:
2C(g) ;ΔH=-92.4 kJ·mol-1,将Y、Z两种单质按物质的量比1∶3充入一密闭容器中。问:
在298 K时,将10 mol Y和30 mol Z充入一密闭容器中,为何放出的热量小于924 kJ?_______________。
(4)C在一定条件下反应生成A的化学方程式是_______________。
(5)X、Y、Z三种元素可组成一种强酸D,C在适当条件下被D吸收生成一种盐E,25 ℃时,0.1 mol·L-1 E溶液中水的电离程度_______________(填“大于”“等于”或“小于”)0.1 mol·L-1 NaOH溶液中水的电离程度。若将0.1 mol·L-1 NaOH溶液和0.2 mol·L-1 E溶液等体积混合,所得溶液中离子浓度由大到小的顺序为_______________。
查看习题详情和答案>>