20.(12分)(2010·广东卷)某研究小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH===__________________________________。
(2)反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中的还原剂为________。
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO,请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
①提出合理假设。
假设1:只存在SO;
假设2:既不存在SO,也不存在ClO-;
假设3:_______________________________。
②设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。
限选实验试剂:3 mol·L-1 H2SO4、1 mol·L-1 NaOH、0.01 mol·L-1KMnO4、淀粉-KI溶液、紫色石蕊试液。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量吸收液于试管中,滴加3
mol·L-1
H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中。 |
|
|
步骤2: |
|
|
步骤3: |
|
解析:本题主要考查实验设计与评价能力,背景知识为氧化还原反应,意在考查考生的实验设计能力,分析与解决问题的能力,本题在对考生实验评价能力的考查上具有特别的价值,是一个既具有新颖性,又不失经典性的好题。(1)SO2与过量NaOH反应的产物为Na2SO3与H2O;(2)在反应中,硫元素的化合价升高,所以Na2SO3为还原剂;(3)SO具有较强的还原性,而ClO-具有极强的氧化性,ClO-与SO是不能共存的,所以假设3为:只存在ClO-,实验设计只要求证实酸化后的溶液是具有氧化性,还是具有还原性,还是既不具有氧化性,也不具有还原性,若加入淀粉-KI溶液会出现蓝色,证明存在ClO-,若加入KMnO4溶液时,KMnO4溶液褪色,证明存在SO,若两种现象均无,则假设2成立。
答案:(1)Na2SO3+H2O (2)Na2SO3
(3)①只存在ClO-
②
|
步骤2:向A试管中滴加1-2滴0.01
mol·L-1
KMnO4溶液。 |
(ⅰ)若溶液褪色,则假设1成立; (ⅱ)若溶液不褪色,则假设2或3成立。 |
|
步骤3:向B试管中滴加1-2滴淀粉-KI溶液。 |
(ⅰ)若溶液变蓝色,则假设3成立; (ⅱ)若溶液不变蓝色,结合步骤2中的(ⅱ),则假设2成立。 |
19.(18分)(2010·北京市海淀区期中)Ⅰ.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
[实验原理]
(NH4)2S2O8和KI反应的离子方程式为:
S2O+2I-===2SO+I2 ①
平均反应速率的计算式为v(S2O)=。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应①进行的同时,发生反应:
2S2O+I2===S4O+2I- ②
反应①生成的I2立即与S2O反应,生成无色的S4O和I-。S2O耗尽时,反应①继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
[实验内容]
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
|
试剂用量(mL) |
0.20
mol·L-1(NH4)2S2O8溶液 |
20.0 |
10.0 |
b_ |
20.0 |
20.0 |
|
0.20
mol·L-1KI溶液 |
20.0 |
20.0 |
20.0 |
10.0 |
5.0 |
|
|
0.010
mol·L-1Na2S2O3溶液 |
a_ |
8.0 |
8.0 |
8.0 |
8.0 |
|
|
0.2%
淀粉溶液 |
2.0 |
2.0 |
2.0 |
2.0 |
2.0 |
|
|
0.20
mol·L-1KNO3溶液 |
0 |
0 |
0 |
10.0 |
c_ |
|
|
0.20
mol·L-1(NH4)2SO4溶液 |
0 |
10.0 |
15.0 |
0 |
0 |
|
|
20℃时,反应时间Δt(s) |
32 |
67 |
130 |
66 |
135 |
|
|
为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变。 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是________。
(3)第①组实验的v(S2O)=________mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)__________________________________________。
Ⅱ.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:
Na2CO3+SO2===Na2SO3+CO2
2Na2S+3SO2===2Na2SO3+3S↓
Na2SO3+S===Na2S2O3
该小组根据上述原理设计如图所示装置制备Na2S2O3。
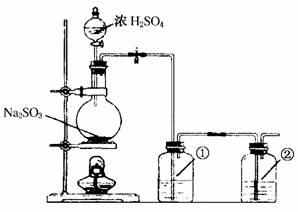
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是①____________;②____________。
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是________________。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括:__________________。
解析:Ⅰ.(1)对题中实验记录表和数据记录进行分析,第②、④组实验中溶液的总体积为50 mL,为了保持溶液的总体积不变,故a为8.0;b为5.0;c为15.0。(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行搅拌。(3)第①组实验的v(S2O)=0.010 mol·L-1×0.008 L×/(0.05 L×32 s)=2.5×10-5mol·(L·s)-1。(4)本题答案较开放,根据表中数据分析,可以得到的结论有:反应物浓度增大反应速率加快;反应速率变化和反应物起始浓度变化存在比例关系;反应物浓度对反应速率的影响和化学计量数无关等。
Ⅱ.(1)①中盛放Na2S溶液、Na2CO3溶液;多余的尾气用NaOH溶液吸收,即②为NaOH溶液。(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,Na2SO3与S反应生成Na2S2O3,可以观察到的现象是沉淀逐渐消失。(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括:加热浓缩、冷却结晶、过滤。
答案:Ⅰ.(1)a 8.0 b 5.0 c 15.0