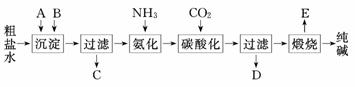
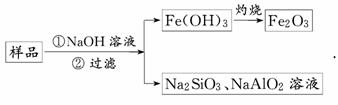
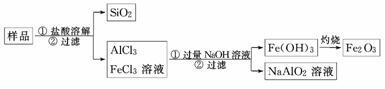
9.某化学兴趣小组在课外活动中,对某一份溶液成分(已知不含其他还原性离子)进行了检测,其中三次检测结果如下表所示:
|
检测序号 |
溶液中检测出的离子组合 |
|
第一次 |
KCl、K2SO4、Na2CO3、NaCl |
|
第二次 |
KCl、AlCl3、Na2SO4、K2CO3 |
|
第三次 |
Na2SO4、KCl、K2CO3、NaCl |
则下列说法合理的是( )
A.三次检测结果都正确
B.该溶液中的阳离子无法判断
C.为了检验SO,应先加过量稀硝酸后再滴加Ba(NO3)2,观察是否有沉淀现象
D.为了确定是否存在CO,可以向其中滴加CaCl2溶液,观察是否有沉淀现象
解析:由于第二组中的AlCl3与K2CO3发生水解相互促进的反应,故不能共存,A错误;阳离子可以通过焰色反应确定,B错误;加入CaCl2溶液时,CaSO4也可能出现沉淀,无法确定一定存在CO,D错误.
答案:C
6.为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是( )
|
选项 |
被提纯的物质(杂质) |
除杂试剂 |
分离方法 |
|
A |
NH3(H2O) |
浓硫酸 |
洗气 |
|
B |
乙酸乙酯(乙酸) |
饱和碳酸钠溶液 |
分液 |
|
C |
KCl固体(I2) |
KOH溶液 |
加热 |
|
D |
苯(苯酚) |
浓溴水 |
过滤 |
解析:NH3不能用浓硫酸干燥;氯化钾是离子化合物,熔点较高,碘单质受热易升华,应用加热法分离出KCl固体;苯中的少量苯酚与浓溴水反应生成的沉淀会溶于苯中.
答案:B