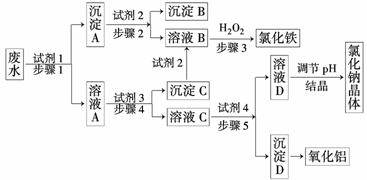
19.(8分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致.则溶液呈黄色是含________(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含________所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的 观点确实是正确的.
观点确实是正确的.
供选用的试剂:
a.酚酞试液 b.四氯化碳
c.无水酒精 d. 硫氰化钾溶液
硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现 象.(试剂填序号)
象.(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
解析:若Fe3+的氧化性大于Br2,则向FeCl2溶液中滴加溴水时,Br2不能把Fe2+氧化成Fe3+,故溶液的黄色是由单质溴引起的,只要用有机溶剂(如CCl4)萃取便可验证.
若Br2的氧化能力大于Fe3+,则向FeCl2溶液中滴加溴水时,Br2能将Fe2+氧化成Fe3+,故溶液中的黄色是由Fe3+引起的,用KSCN溶液检验溶液中是否存在Fe3+便可验证.
答案:(2)①Br2 ②Fe3+
(3)d 溶液呈红色 b CCl4层呈无色
13.(2010·临沂模拟)类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
|
选项 |
 已知 已知 |
类推 |
|
A |
将Fe加入CuSO4溶液中Fe+Cu2+=== Cu+Fe2+ |
将Na加入到CuSO4溶液 中2Na+Cu2+=== Cu+2Na+ 中2Na+Cu2+=== Cu+2Na+ |
|
B |
稀硫酸与Ba(OH)2溶液反应至中性2H++SO+Ba2++2OH-=== BaSO4↓+2H2O |
NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO+Ba2++2OH-=== BaSO4↓+2H2O |
|
C |
氯气与Ca(OH)2悬浊液反应Cl2+Ca(OH)2=== Ca2++Cl-+ClO-+H2O |
氯气与CaCO3悬浊液反应Cl2+CaCO3 ===Ca2++Cl-+ClO-+CO2↑ |
|
D |
向Ca(ClO)2溶液中通入少量CO2Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO |
向Ca(Cl O)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO O)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
解析:Na加入到CuSO4溶液中,Na先与水反应,A错误;Cl2先与水反应,生成的盐酸与Ca(OH)2和CaCO3都能反应,但次氯酸只能与Ca(OH)2反应,不与CaCO3反应,C错误;HClO能将CaSO3氧化,D错误.
答案:B