10.(2010·重庆高考)已知H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ/mol,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他数据如下表:
|
|
H2(g) |
Br2(g) |
HBr(g) |
|
1
mol分子中的化学键 断裂时需要吸收的能量/Kj |
436 |
a |
369 |
则表中a为( )
A.404 B.260
C.230 D.200
解析:1 mol H2(g)与1 mol Br2(g)完全反应生成2 mol HBr(g)的ΔH1=-(369×2-436-a)=-(302-a) kJ/mol

则ΔH=ΔH2+ΔH1
即-72 kJ/mol=+30 kJ/mol+[-(302-a)kJ/mol]
=30 kJ/mol-302 kJ/mol+a
a=200
答案:D
7.(2010·邯郸模拟)一些烷烃的燃烧热如下表:
|
化合物 |
燃烧热(kJ/mol) |
化合物 |
燃烧热(kJ/mol) |
|
甲烷 |
890.3 |
正丁烷 |
2878.0 |
|
乙烷 |
1560.8 |
异丁烷 |
2869.6 |
|
丙烷 |
2221.5 |
2-甲基丁烷 |
3531.3 |
下列表达正确的是( )
A.乙烷燃烧的热化学方程式为: 2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g);ΔH=-1560.8 kJ/mol
2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g);ΔH=-1560.8 kJ/mol
B.稳定性:正丁烷>异丁烷
C.正戊烷的燃烧热大于3531.3 kJ/mol
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
解析:选项A,所给的热化学方程式中H2O为非稳定的气态,且ΔH值也与化学计量数不符,错误.选项B,等物质的量的正丁烷燃烧释放出的热量大于异丁烷,说明正丁烷具有的总能量大于异丁烷,所以异丁烷的稳定性大于正丁烷.选项C,根据正丁烷的燃烧热大于异丁烷,推知正戊烷的燃烧热大于2-甲基丁烷的燃烧热,即大于3531.3 kJ/mol.选项D,相同质量的烷烃,氢的质量分数越大,燃烧放出的热量越多.
答案:C
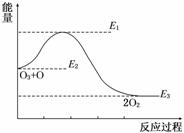
 2NH3(g);ΔH=-92.4 kJ/mol,在该条件下,下列叙述正确的是( )
2NH3(g);ΔH=-92.4 kJ/mol,在该条件下,下列叙述正确的是( )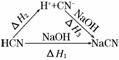 解析:根据盖斯定律,将HCN与NaOH的反应设计为以下两步:
解析:根据盖斯定律,将HCN与NaOH的反应设计为以下两步: B.H2O(g)===H2O(l);ΔH=-44.0 kJ/mol
B.H2O(g)===H2O(l);ΔH=-44.0 kJ/mol