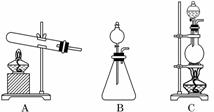
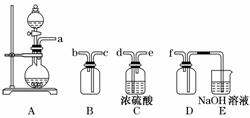
4.(2010·莆田模拟)实验室可采用多种方法制取氨气.
(1)请从下图中选择最恰当的气体发生装置,将相应字母标号填入下表:
|
方法 |
Ⅰ |
Ⅱ |
…… |
|
试剂 |
仅用浓氨水 |
浓氨水、氢氧化钠固体 |
…… |
|
装置 |
|
|
…… |
(2)如何检验生成的气体是氨气?______________________________________________.
解析:(1)实验室制取氨气,可以采取加热浓氨水的方法,装置选择C;也可以选用氢氧化钠固体和浓氨水,向NaOH固体中滴加浓氨水,NaOH固体溶解放热,氨气受热挥发,故装置选择B.
(2)检验氨气,可以利用氨气能使湿润的红色石蕊试纸变蓝的性质检验.
答案:(1)C B
(2)把湿润的红色石蕊试纸靠近导管口,试纸变蓝
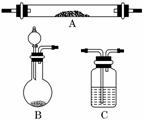
13.(13分)已知Zn跟一定量的浓H2SO4反应生成的气体产物有两种,请从下图中选用所需的仪器组成一套进行该反应并检出气体产物的装置(装置可重复选用,假设每步反应都完全进行,且无需干燥).现提供Zn、浓H2SO4,其他试剂自选(固定仪器用的铁夹、铁架台及加热装置等均略去).将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加的试剂、作用及现象.(可不填满,也可加行)
|
选用的仪器(填字母) |
加入的试剂 |
作用 |
现象 |
|
|
Zn、浓H2SO4 |
产生两种气体 |
- |
|
|
|
|
|
|
|
|
除SO2 |
- |
|
|
|
|
|

解析:Zn与一定量的浓H2SO4反应生成SO2和H2两种气体,发生装置选择装置B;检验SO2用品红溶液,选择装置C,现象是品红溶 液褪色;除去SO2用NaOH溶液,选择装置C;检验H2用黑色CuO粉末,选择装置A,现象是加热后固体由黑色变为红色.
液褪色;除去SO2用NaOH溶液,选择装置C;检验H2用黑色CuO粉末,选择装置A,现象是加热后固体由黑色变为红色.
答案:
|
选用的仪器(填字母) |
加入的试剂 |
作用 |
现象 |
|
B |
|
|
- |
|
C |
品红溶液 |
检验SO2 |
品红溶液褪色 |
|
C |
NaOH溶液 |
|
- |
|
A |
CuO |
检验H2 |
加热后固体由黑变红 |
11.(11分)(2010·唐山模拟)教材中经常利用如图装置进行有关物质的制备和性质实验.
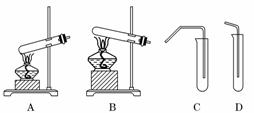
(1)请按要求填充下表空格:
|
实验名称 |
选用的仪器(填字母) |
C或D中所盛试剂(填名称) |
C或D中的现象 |
|
区别固体Na2CO3和NaHCO3 |
BD |
澄清石灰水 |
|
|
铜和浓硫酸反应 |
AC |
|
溶液红色褪去 |
|
制备乙酸乙酯 |
|
饱和碳酸钠溶液 |
上层有透明油状液体产生并有香味 |
(2)针对上述实验下列说法正确的是(填写字母代号)________.
A.Cu和浓硫酸反应时,可在装置C的试管口塞沾有碱液的棉花
B.加热装置C中已吸收Cu和浓硫酸反应生成物后的溶液不能出现红色
C.制备乙酸乙酯时,装置C的导管末端在液面以下
D.装置B可用于制备氨气
解析:(1)碳酸氢钠受热分解产生二氧化碳,二氧化碳使澄清石灰水变浑浊;根据现象“溶液红色褪去”及铜与浓硫酸反应的产物可知加入的试剂为品红溶液;实验室中制备乙酸乙酯的反应物为液体,所以选用装置A作为反应器,用装置C作为乙酸乙酯的接收装置及除杂装置.
(2)铜与浓硫酸反应容易逸出有毒气体二氧化硫,该气体可以溶解在碱液中,所以可以用沾有碱液的棉花吸收,A正确;品红溶液吸收二氧化硫生成不稳定的无色物质,加热可以释放出二氧化硫,品红溶液恢复红色,B错误;为了防止倒吸,制备乙酸乙酯时,装置C的导管不能插入吸收液中,C错误;装置B是加热固体反应物的装置,可以制备氨气,D正确.
答案:(1)
|
|
|
|
|
|
|
|
|
澄清石灰水变浑浊 |
|
|
|
品红溶液 |
|
|
|
AC |
|
|
(2)AD
10.已知在温度低于570℃时,还原铁粉与水蒸气反应的产物是FeO,高于570℃时,生成Fe3O4.老师用如图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验.
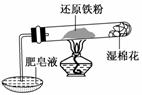
甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
|
实验编号 |
实验操作 |
实验现象 |
|
① |
取少量黑色粉末放入试管中,加入盐酸,微热 |
黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
|
② |
向试管中滴加几滴KSCN溶液,振荡 |
溶液没有出现红色 |
根据上述实验,下列说法不正确的是( )
A.试管内的固体一定含有铁粉
B.试管内的固体一定不含有Fe3O4
C.不能确定试管内的固体是否含有FeO
D.可通过将试管内固体彻底还原,分析其质量减小的方法来确定是否含有Fe3O4
解析:由加入盐酸溶解时有少量气泡产生,说明黑色粉末中含有铁粉,因铁粉能与三价铁离子反应生成二价铁离子,故不能确定黑色粉末中是否含有Fe3O4,B项错误.
答案:B
 应,静置后见紫红色褪去,表明MnO为紫红色.
应,静置后见紫红色褪去,表明MnO为紫红色.


 过滤
过滤