2.研究下表信息可直接得出的结论是( )
|
元素 |
F |
Cl |
Br |
I |
|
氢化物组成 |
HF |
HCl |
HBr |
HI |
|
氢化物形成难易程度 |
H2、F2混合,冷暗处剧烈化合并发生爆炸 |
H2、Cl2混合,光照或点燃时发生爆炸 |
H2与Br2混合,加热发生化合 |
H2、I2混合,加热化合,同时又分解 |
|
氢化物热稳定性 |
很稳定 |
稳定 |
较稳定 |
较不稳定 |
A.元素的性质随原子序数的递增而呈周期性变化
B.同周期元素的非金属性随原子序数的递增而增强
C.ⅦA族元素的金属性随电子层数的增加而减弱
D.ⅦA族元素的非金属性随电子层数的增加而减弱
解析:表格中反映的是第ⅦA元素非金属性的递变规律,随 着原子序数的增加,元素的非金属性逐渐减弱.
着原子序数的增加,元素的非金属性逐渐减弱.
答案:D
13.(15分)(2010·福建高考)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表:J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
|
|
J |
|
|
|
|
|
|
|
R |
|
(1)M的离子结构示意图为________;元素T在周期表中位于第________族.
(2)J和氢组成的化合物分子有6个原子,其结构简式为________.
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为________________________________________________________________________.
(4)L的最简单气态氢化物甲的水溶液显碱性.
在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________________________________________.
(5)由J、R形成的液态化合物JR20.2 mol在O2中完全燃烧,生成两种气态氧化物,298 K时放出热量215 kJ.该反应的热化学方程式为___________________________________.
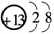
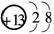 解析:本题考查元素的推断,意在考查考生的分析推断能力.根据J元素最低负化合价的绝对值与其原子最外层电子数相等,则J的最低负价为-4,位于ⅣA族,又五种元素均为短周期主族元素,则J为C,R为S,T的原子序数比R大,则T
解析:本题考查元素的推断,意在考查考生的分析推断能力.根据J元素最低负化合价的绝对值与其原子最外层电子数相等,则J的最低负价为-4,位于ⅣA族,又五种元素均为短周期主族元素,则J为C,R为S,T的原子序数比R大,则T 只能为Cl;根据M是地壳中含量最多的金属元素,则M为Al.(1)Al3+的结构示意图为
,Cl位于元素周期表第ⅦA族.(2)C和H组成的含6个原子的化合物为乙烯,其结构简式为CH2===CH2.(3)Al和Cl形成的化合物为AlCl3,在潮湿的空气中发生水解反应,产生白色烟雾.(4)L的最简单气态氢化物甲的溶液显碱性,则L为N,甲为NH3.结合提供信息,可以推断NH3和H2O2反应生成N2和H2O.
只能为Cl;根据M是地壳中含量最多的金属元素,则M为Al.(1)Al3+的结构示意图为
,Cl位于元素周期表第ⅦA族.(2)C和H组成的含6个原子的化合物为乙烯,其结构简式为CH2===CH2.(3)Al和Cl形成的化合物为AlCl3,在潮湿的空气中发生水解反应,产生白色烟雾.(4)L的最简单气态氢化物甲的溶液显碱性,则L为N,甲为NH3.结合提供信息,可以推断NH3和H2O2反应生成N2和H2O.
答案:(1) ⅦA (2)CH2===CH2
(3)AlCl3+3H2O===Al(OH)3+3HCl↑
(4)2NH3·H2O+3H2O2===N2↑+8H2O(或2NH3+3H2O2===N2↑+6H2O)
(5)CS2(l)+O2(g)===CO2(g)+SO2(g);
ΔH=-215 kJ·mol-1
10.研究下 表信息可直接得出的结论是( )
表信息可直接得出的结论是( )
|
元素 |
F |
Cl |
Br |
I |
|
氢化物组成 |
HF |
HCl |
HBr |
HI |
|
氢化物形成难易程度 |
H2、F2混合,冷暗处剧烈化合并发生爆炸 |
H2、Cl2混合,光照或点燃时发生爆炸 |
H2与Br2混合,加热发生化合 |
H2、I2混合,加热化合,同时又分解 |
|
氢化物热稳定性 |
很稳定 |
稳定 |
较稳定 |
较不稳定 |
A.元素的性质随原子序数的递增而呈周期性变化
B.同周期元素的非金属性随原子序数的递增而增强
C.ⅦA族元素的金属性随电子层数的增加而减弱
D.ⅦA族元素的非金属性随电子层数的增加而减弱
解析:表格中反映的是第ⅦA族元素非金属性的递变规律,随着原子序数的递增,元素的非金属性逐渐减弱.
答案:D
 ,以此来纪念科学家伦琴诞辰111周年.第111号元素的某种核素的质量数为272.下列关于第111号元素的叙述正确的是( )
,以此来纪念科学家伦琴诞辰111周年.第111号元素的某种核素的质量数为272.下列关于第111号元素的叙述正确的是( ) 电子,H形成1对共用电子,故其结构式为H-N==N-H.
电子,H形成1对共用电子,故其结构式为H-N==N-H. (4)NH4NO3溶液呈酸性是NH水解所致:NH+H2O NH3·H2O+H+.
(4)NH4NO3溶液呈酸性是NH水解所致:NH+H2O NH3·H2O+H+. ?
?
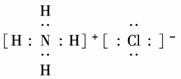 (4)戊是第三周期中简单离子半径最小的元素,则为Al元素,它的最高价氧化物对应的水化物是Al(OH)3.它能与强碱发生反应生成AlO.
(4)戊是第三周期中简单离子半径最小的元素,则为Al元素,它的最高价氧化物对应的水化物是Al(OH)3.它能与强碱发生反应生成AlO.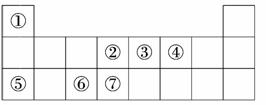
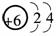 (4)元素⑥的最高价氧化物溶解于①④⑤三种元素组成的化合物的溶液中,离子方程式为________________________________________________________________________.
(4)元素⑥的最高价氧化物溶解于①④⑤三种元素组成的化合物的溶液中,离子方程式为________________________________________________________________________.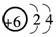 (4)元素⑥为Al,其最高价氧化物为Al2O3,元素①、④、⑤分别为H、O、Na,组成的化合物为NaOH,Al2O3溶于NaOH溶液的离子方程式为Al2O3+2OH-===2AlO+H2O.
(4)元素⑥为Al,其最高价氧化物为Al2O3,元素①、④、⑤分别为H、O、Na,组成的化合物为NaOH,Al2O3溶于NaOH溶液的离子方程式为Al2O3+2OH-===2AlO+H2O.
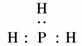
 .
.