13.(12分)2010年8月7日,甘肃甘南藏族自治州舟曲县发生特大泥石流,造成大量人员伤亡,其中饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
|
阳离子 |
K+、Na+、Cu2+、Al3+ |
|
阴离子 |
SO、HCO、NO、OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象填写下列空白:
(1)写出B、D的化学式:B________、D________.
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为________.
(3)写出实验②发生反应的离子方程式_______________________________________
________________________________________________________________________.
(4)C常用作净水剂,用离子方程式表示其净水原理______________________________
________________________________________________________________________.
解析:根据实验①判断D中含有Cu2+;由实验②可知C中含有Al3+,E可能是NaOH或KOH,再依据实验③可知B、C中含有K+,故E为NaOH;根据实验④判断A中含有HCO,C、D中含有SO,故A为NaHCO3,D为CuSO4,而物质C中含有K+、Al3+和SO,则C为复盐KAl(SO4)2.
答案:(1)KNO3 CuSO4
(2)Na2CO3
(3)Al3++3OH-===Al(OH)3↓;Al(OH)3+OH-===AlO+2H2O
(4)Al3++3H2O===Al(OH)3(胶体)+3H+
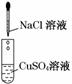
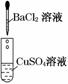
12.(14分)为了确认电解质溶液中部分离子相互间能否发生反应,做了如下三组实验
|
编 号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
实 验 |
 |
 |
 |
(1)实验Ⅰ的目的是_________________________________________________________.
(2)实验Ⅱ证明了________和________发生了化学反应,根据什么现象证明溶液中的另两种离子没有发生化学反应______________________________________________________.
(3)实验Ⅲ中的反应现象________________________________.反应的离子方程式为________________________________________________________________________.
解析:实验Ⅰ是实验Ⅱ和实验Ⅲ的对照实验,虽然实验Ⅰ中没有任何实验现象,其中没有发生化学反应,但有了这一实验可以帮助判断实验Ⅱ、实验Ⅲ中分别是哪几种离子发生了化学反应.设计实验Ⅰ的目的是证明溶液中Na+与SO、Cl-与Cu2+四种离子间不能发生反应.实验Ⅰ和实验Ⅱ联系起来就可判断,实验Ⅱ中是Ba2+跟SO之间发生反应生成硫酸钡沉淀.因为实验Ⅰ中证明Cl-、Cu2+间不发生反应,而且反应后溶液仍显蓝色,说明Cu2+仍存在于反应后的溶液中.所以实验Ⅱ的滤液中含有Cu2+、Cl-,往其中滴入硝酸银溶液后,产生白色沉淀,溶液仍显蓝色,说明实验Ⅲ中是Cl-和Ag+反应生成氯化银沉淀.
答案:(1)证明溶液中的Na+和SO、Cl-和Cu2+相互间不发生反应
(2)Ba2+ SO 过滤后得到的溶液呈蓝色
(3)产生白色沉淀,溶液呈蓝色
Ag++Cl-===AgCl↓
9.(2010·合肥模拟)某混合溶液中所含离子的浓度如下表,则Mn+及a值可能为( )
|
所含离子 |
NO |
SO |
H+ |
Na+ |
Mn+ |
|
浓度(mol/L) |
3 |
1 |
2 |
1 |
a |
A.Mg2+、1 B.Ba2+、0.5
C.Al3+、1.5 D.Fe2+、2
解析:溶液中存在电荷守恒:
c(H+)+c(Na+)+nc(Mn+)=c(NO)+2c(SO)
2+1+na=3+2×1
na=2
当n=3时,a=,(不合理)
n=2时,a=1,(合理).
答案:A
7.(2010·陕西高考)下表中评价合理的是( )
|
选项 |
化学反应及其离子方程式 |
评价 |
|
A |
Fe3O4与稀硝酸反应: 2Fe3O4+18H+===6Fe3++H2↑+8H2O |
正确 |
|
B |
向碳酸镁中加入稀盐酸: CO+2H+===CO2↑+H2O |
错误,碳酸镁不应写成离子形式 |
|
C |
向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO===BaSO4↓ |
正确 |
|
D |
FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2 |
错误,Fe2+与Br-的化学计量数之比应为1∶2 |
解析:Fe3O4与稀HNO3反应不会产生H2,而是放出NO气体,A错误;(NH4)2SO4与Ba(OH)2反应时除产生BaSO4沉淀外,还生成NH3·H2O,C错误;选项D中的离子方程式书写正确.
答案:B

