14. (18分)(2010·四川高考)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.
(18分)(2010·四川高考)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.
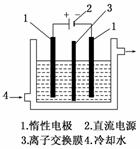
碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
请回答下列问题:
(1)碘是________(填颜色)固体物质,实验室常用________方法来分离提纯含有少量杂质的固体碘.
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH===5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.
电解时,阳极上发生反应的电极反应式为________;阴极上观察到的实验现象是________________________________________________________________________.
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表.
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选.
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸.
|
实验方法 |
实验现象及结论 |
|
|
|
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
阳极电解液―→―→②―→―→―→⑤―→碘酸钾晶体
步骤②的操作名称是________,步骤⑤的操作名称是________.步骤④洗涤晶体的目的是________________________________________________________________________.
解析:(1)卤素单质的颜色随着相对分子质量的增加而变深,单质碘为紫黑色,具有加热易升华的性质.
(2)电解时,阳极发生氧化反应,I-失去电子被氧化;阴极发生还原反应,H+得电子生成氢气.
(3)阳极电解产物中含有IO,该离子与I-在酸性条件下可以发生氧化还原反应生成单质碘,可用淀粉溶液检验生成的单质碘.
(4)溶液经蒸发浓缩,冷却后析出晶体,然后过滤得目标产物KIO3,洗涤其表面的杂质,干燥后即得较为纯净的KIO3.
答案:(1)紫黑色 升华
(2)2I--2e-===I2(或I-+6OH--6e-===IO+3H2O) 有气泡 产生
产生
(3)
|
实验方法 |
实验现象及结论 |
|
取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉溶液,观察是否变蓝. |
如果不变蓝,说明无I-. (如果变蓝,说明有I-) |
(4)冷却结晶 干燥 洗去吸附在碘酸钾晶体上的氢氧化钾等杂质

 l和HIO3.
l和HIO3.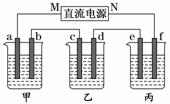
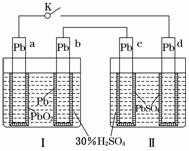
 Ⅱ可单独作为原电池,d电极为正极
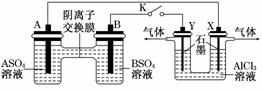
Ⅱ可单独作为原电池,d电极为正极 水.当K闭合时,SO从右向左通过交换膜移向A极.下列分析正确的是
( )
水.当K闭合时,SO从右向左通过交换膜移向A极.下列分析正确的是
( )
 Cd+2NiOOH+2H2O.有关该电池的说法中,不正确的是( )
Cd+2NiOOH+2H2O.有关该电池的说法中,不正确的是( )
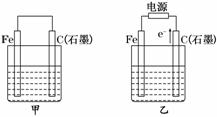
 (3)利用右图装置,可以模拟铁的电化学防护.
(3)利用右图装置,可以模拟铁的电化学防护. H++6e-.加入NaHCO3溶液后,Al3+与HCO发生水解相互促进反应,离子方程式可表示为Al3++3HCO===Al(OH)3↓+3CO2↑.
H++6e-.加入NaHCO3溶液后,Al3+与HCO发生水解相互促进反应,离子方程式可表示为Al3++3HCO===Al(OH)3↓+3CO2↑.