3.(2010·杭州模拟)下列实验能达到预期目的的是( )
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2的水溶液具有弱酸性 |
|
B |
向少量火柴头的浸泡液中滴加AgNO3、稀HNO3和NaNO2 |
验证火柴头含有氯元素 |
|
C |
在淀粉-KI溶液中滴加少量市售食盐配制的溶液 |
真假碘盐的鉴别 |
|
D |
在少量Fe(NO3)2试样加水溶解的溶液中,滴加稀H2SO4酸化,再滴加KSCN溶液 |
检验Fe(NO3)2试样是否变质 |
解析:SO2通入酸性KMnO4溶液中,由于SO2的还原性使酸性高锰酸钾溶液褪色,A错;用淀粉-KI溶液鉴别市售食盐中是否含有KIO3时,需要加入盐酸酸化:5I-+IO+6H+===3I2+3H2O,C错;在少量Fe(NO3)2试样加水溶解的溶液中滴加稀硫酸,Fe2+会转化为Fe3+,3Fe2++4H++NO===3Fe3++NO↑+2H2O,因此再滴加KSCN溶液无论试样是否变质,溶液均会变为红色,D错.
答案:B
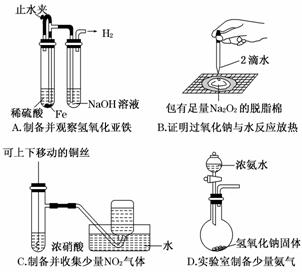

 NaOH,否则加入AgNO3溶液时,会生成Ag2O而产生干扰.选项B,溴水不能与苯发生取代反应,应使用液溴.选项C,应使用浓溴水与苯酚反应.选项D,Cu加热时生成CuO,CuO与CH3CH2OH反应时,CuO又被还原为红色的Cu.
NaOH,否则加入AgNO3溶液时,会生成Ag2O而产生干扰.选项B,溴水不能与苯发生取代反应,应使用液溴.选项C,应使用浓溴水与苯酚反应.选项D,Cu加热时生成CuO,CuO与CH3CH2OH反应时,CuO又被还原为红色的Cu.
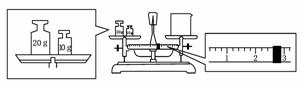
 g,此时必须注意:标尺的每个小格代表0.2 g.
g,此时必须注意:标尺的每个小格代表0.2 g.
 春运期间,一些易燃、易爆、剧毒品、易腐蚀品等,严禁旅客带上车.下列化学品,可允许旅客带上车的有( )
春运期间,一些易燃、易爆、剧毒品、易腐蚀品等,严禁旅客带上车.下列化学品,可允许旅客带上车的有( )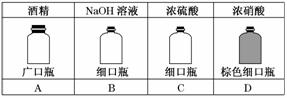

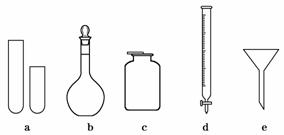
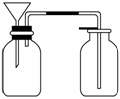 ③丙同学想用右图装置用大理石和稀盐酸反应制取CO2.教师指出,这需要太多的稀盐酸,造成浪费.该同学选用了上面的一种仪器,加在装置上,解决了这个问题,请你把该仪器画在图中合适的位置.
③丙同学想用右图装置用大理石和稀盐酸反应制取CO2.教师指出,这需要太多的稀盐酸,造成浪费.该同学选用了上面的一种仪器,加在装置上,解决了这个问题,请你把该仪器画在图中合适的位置.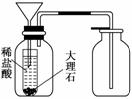 答案:(1)检查酸式滴定管是否漏液
答案:(1)检查酸式滴定管是否漏液