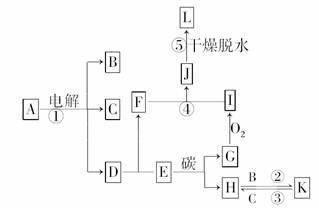
(1)由图象信息写出反应的化学方程式:
例1.某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图1,由图中的数据分析该反应的化学方程式为 。反应开始至2 min,Z的平均反应速率为 。
min,Z的平均反应速率为 。
解析:化学方程式书写关键是确定反应物和生成物及它们对应的系数。一般地,反应物的量随时间不断减小,生成物则是不断增加。化学方程式各物质的化学计量系数之比等于相应物质的物质的量的变化量的比值。
(2)化学反应速率与各影响因素的关系。
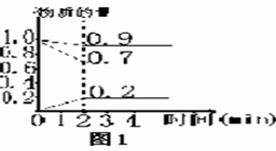
例2.把镁条投入盛有盐酸的烧杯里,产生氢气的速率可由图2,在下列因素中:①.H+浓度;②.镁条的表面积;③.溶液的浓度;④.Cl-浓度。影响反应速率的因素是()。
 A.①④B.③④.C.①②③D.②③
A.①④B.③④.C.①②③D.②③
解析:由Mg+2H+==Mg2++H2↑可知Cl--不影响反应速率,温度越高,反应速率越大;随反应的进行,H+浓度不断减小,则反映速率逐渐减慢。
(3)P、T对化学反应速率的影响:
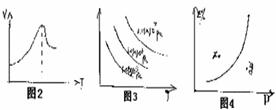
例3.如图3表示外界条件(温度、压强)的变化对下列反应L(S)+G(g)==2R(g)-Q的影响,在图中Y轴是指()
A.平衡混合物中R的体积分数B.平衡混合物中G的体积分数
C.G的转化率 D.L的转化率
解析:曲线反应的是温度、压强与Y之间的关系,且温度升高,Y减小,压强增大Y增大。根据化学方程式及选项的要求得出结论。
例4.在mA(S)+nB(g==pC(g)+Q的可逆反应中,在一定温度的条件下,B的质量分数与压强的关系如图4,有关叙述正确的是()
A.m+n<P B.n>p C.x点时,正反应速率大于逆反应速率
D.x点的反应速率比y点的小E.y点时,正反应速率大于逆反应速率
解析:由图象曲线可知:Z%随压强增大而增大,故增大压强平衡逆向移动,又因为A为固体,则n< p,故A,B均错误;x、y两点均未达到平衡状态,其中x
p,故A,B均错误;x、y两点均未达到平衡状态,其中x 点表示从正反应开始达到平衡状态前的某个状态,在一定温度和压强下,从正反应由大到小,最后达到平衡,所以正反应速率大于逆反应速率。Y点表示在一定温度和压强下,从逆反应开始;
点表示从正反应开始达到平衡状态前的某个状态,在一定温度和压强下,从正反应由大到小,最后达到平衡,所以正反应速率大于逆反应速率。Y点表示在一定温度和压强下,从逆反应开始; 从图可知,y点压强大于x点压
从图可知,y点压强大于x点压 强,则可知y点反应速率大于x点反应速率。
强,则可知y点反应速率大于x点反应速率。
(4).根据图示进行有关计算。
例5.把大气中的游离态的氮转化为氮的化合物的过程称为固氮。生物固氮和大气固氮(闪电时N2转化为NO)属于自然固氮,这远不能满足人类的需要。工业固氮(合成氨)是目前人工固氮的主要方法。有关大气固氮和工业固氮的平衡常数K值分别如下表一和表二。
表一:N2 + O2 ⇌2NO
|
温度 |
27℃ |
2000℃ |
|
K值 |
3.84×10-31 |
0.1 |
表二:N2 + 3H2 ⇌2NH3
|
温度 |
25℃ |
350℃ |
400℃ |
450℃ |
|
K值 |
5×108 |
1.847 |
0.507 |
0.152 |
(1)根据上表中的 数据分析,下列说法正确的是_________。
数据分析,下列说法正确的是_________。
a.在常温下,大气固氮几乎不可能,而工业固氮非常容易进行
b.人类大规模模拟大气固氮是无意义的
c.在常温下,大气固氮与工业固氮完成程度相差很大
d.大气固氮与工业固氮都是放热反应
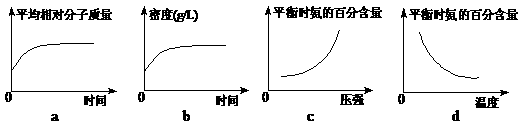
(2)在一定条件下,工业固氮在一固定体积的密闭容器中进行直至平衡, 有人画出了下列图像a和b;达到平衡后,向密闭容器中分别充入稀有气体或升高温度,有人又分别画出了如下图像c和d。其中有关图像正确的是______________(填编号)。
有人画出了下列图像a和b;达到平衡后,向密闭容器中分别充入稀有气体或升高温度,有人又分别画出了如下图像c和d。其中有关图像正确的是______________(填编号)。
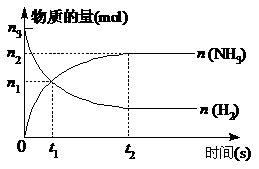
(3)在一定条件下,工业固氮反应在体积为VL的
密闭容器中进行,有关图像如右图,则用H2
表示从开始到平衡时该反应的平均速率:
v=_______________________。
解析:(1) 由表中数据可得,在常温下,大气固氮的K值很小,但也可能固氮,而工业固氮的K值很大。又由表中数据分析得出,表一的平衡常数均随温度升高而增大,即均升温平衡正向移动,因此正向是吸热反应;而表二的平衡常数均随温度升高而减小,即均升温平衡逆向移动,因此正向是放热反应,所以选项bc符合题意。
(2)在一定条件下,工业固氮N2 +3H2 ⇌2NH3在一固定体积的密闭容器中进行,因为混合气体总质量不变(质量守恒定律),而总物质的量减小直至平衡,因而平均相对分子质量增大直至平衡保持不变,a正确。又因混合气体总质量不变,而容器体积不变,即气体体积也不变,所以气体的密度始终不变,b错误。达到平衡后,向密闭容器中充入稀有气体时,虽然容器内压强增大,但N2、H2、NH3的浓度(或其分压)不变,因此平衡不移动,平衡时氨的百分含量不变,故c错误。而达到平衡后,向密闭容器中升高温度,由于正反应放热,平衡逆向移动,所以平衡时氨的百分含量减小,故d正确。
(3)因为图中没有标出H2平衡时的物质的量,所以H2的浓度变化量无法求出,只能先求出NH3的速率,再根据速率之比等于化学计量数之比,求H2的速率了。在0→t2时间内,NH3的浓度变化量为n2/V mol/L,则NH3的速率为n2/Vt2 mol/(L· s),所以H2的速率为
s),所以H2的速率为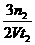 mol/(L·s)。
mol/(L·s)。
11.如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质).将所选答案的编号填入表内相应的空格内(如果不需要外加试剂,则对应答案栏可不填).
可供选择的试剂:A.盐酸 B.氢氧化钠溶液 C.氧气 D.水 E.二氧化碳
可供选用的操作:①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶
|
|
粉末状混合物 |
试剂 |
方法 |
|
(1) |
CaCO3(SiO2) |
|
|
|
(2) |
NaCl(SiO2) |
|
|
|
(3) |
SiO2(Fe2O3) |
|
|
|
(4) |
SiO2(CaCO3) |
|
|
|
(5) |
SiO2(H2SiO3) |
|
|
|
(6) |
SiO2(NH4Cl) |
|
|
解析:可根据二氧化硅是不溶于水的酸性氧化物,它可跟强碱反应,不跟酸(氢氟酸除外)反应,受热不分解等性质来选择,而三氧化二铁、碳酸钙跟盐酸反应;硅酸、氯化铵受热分解.通过一定操作,即可除去杂质,除杂过程中所发生的化学方程式如下:
(1)SiO2+2NaOH===Na2SiO3+H2O
(3)Fe2O3+6HCl===2FeCl3+3H2O
(4)CaCO3+2HCl===CaCl2+CO2↑+H2O
(5)H2SiO3SiO2+H2O
(6)NH4ClNH3↑+HCl↑
答案:(1)B ④ (2)D ④⑤ (3)A ④ (4)A ④ (5)③ (6)②
 )
) 式是 ;
式是 ; 3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KmnO4的理论产量;
3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KmnO4的理论产量;