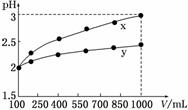
14.(14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
甲 |
乙 |
丙 |
丁 |
|
c(HA)(mol/L) |
0.2 |
c1 |
0.1 |
0.1 |
|
c(NaOH)(mol/L) |
0.2 |
0.2 |
0.1 |
0.1 |
|
混合溶液的pH |
=a |
=7 |
>7 |
=9 |
请回答下列问题:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:_______________________________________________________________
________________________________________________________________________;
(2)不考虑其他组的实验结果,从乙组情况分析,c1是否等于0.2 mol/L________(填“是”、“否”或“不一定”),混合溶液中c(A-)与c(Na+)的大小关系是________(填序号).
A.前者大 B.后者大
C.相等 D.无法判断
(3)丙组混合溶液中离子浓度由大到小的顺序是____________________________.
(4)丁组实验所得混合溶液中,c(Na+)-c(A-)=______ mol/L.
解析:(1)因NaOH是强碱,甲组中酸碱的物质的量相同,二者恰好完全反应,故溶液的酸碱性取决于A-能否水解,即取决于HA是强酸还是弱酸.
(2)若HA为强酸时,c1=0.2 mol/L时,pH=7;若HA为弱酸时,c1>0.2 mol/L时,才能使pH=7.依电荷守恒有:c(Na+)+c(H+)=c(A-)+c(OH-),溶液的pH=7时,c(A-)=c(Na+).
(3)丙组溶液中两者等物质的量反应后,溶液呈碱性,说明HA是弱酸,生成的强碱弱酸盐水解呈碱性.
(4)由盐溶液水解及水电离的相关知识可得水电离出的c(OH-)=10-5 mol/L,则丁组实验中c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9) mol/L.
答案:(1)a=7时,HA是强酸;a>7时,HA是弱酸
(2)不一定 C
(3)c(Na+)>c(A-)>c(OH-)>c(H+)
(4)(10-5-10-9)

12.(10分)如图所示三个烧瓶中分别装入含酚酞的0.01 mol/LCH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.
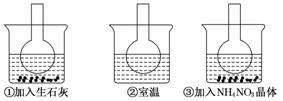
(1)含酚酞的0.01 mol/L CH3COONa溶液显浅红色,其原因为____________________.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是________.
A.水解反应为放热反应
B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量
D.NH4NO3溶于水时吸收热量
(3)向烧瓶②中加入少量下列物质,写出水解平衡移动的方向
|
加入的物质 |
平衡移动的方向 |
|
盐酸 |
|
|
Na2CO3固体 |
|
|
FeSO4固体 |
|
|
H2O |
|
解析:(1)CH3COONa溶液中因CH3COO-水解而使溶液呈碱性,故能使酚酞试液变红色.
(2)NH4NO3溶于水吸收热量,溶液红色变浅,说明溶液中c(OH-)减小,即降低温度能抑制CH3COO-的水解,因此水解反应为吸热反应.
(3)加水稀释,加盐酸和FeSO4固体均能促进CH3COO-的水解,而加入Na2CO3能抑制CH3COO-的水解.
答案:(1)CH3COO-+H2O CH3COOH+OH-,使溶液显碱性
CH3COOH+OH-,使溶液显碱性
(2)BD (3)右 左 右 右