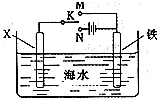
摘要:13.对金属制品进行抗腐蚀处理.可延长其使用寿命. (1)以下为铝材表面处理的一种方法: ①碱洗的目的是除去铝材表面的自然氧化膜.碱洗时常有气泡冒出.原因是 .为将碱洗槽液中的铝以沉淀形式回收.最好向槽液中加入下列试剂中的 . a.NH3 b.CO2 c.NaOH d.HNO3 ②以铝材为阳极.在H2SO4溶液中电解.铝材表面形成氧化膜.阳极电极反应式为 .取少量废电解液.加入NaHCO3溶液后产生气泡和白色沉淀.产生沉淀的原因是 . (2)镀铜可防止铁制品腐蚀.电镀时用铜而不用石墨作阳极的原因是 . (3)利用右图装置.可以模拟铁的电化学防护. 若X为碳棒.为减缓铁的腐蚀.开关K应置于 处.若X为锌.开关K置于M处.该电化学防护法称为 . 解析:(1)①题中指出在碱洗时有气泡产生.则只有金属铝和碱反应才符合条件.故碱洗过程中发生反应的离子方程式为Al2O3+2OH-===2AlO+H2O.2Al+2OH-+2H2O===2AlO+3H2↑.碱洗后溶液中含有大量AlO.故最好通入CO2气体使AlO转化为Al(OH)3沉淀以回收铝. ②活泼金属作阳极.阳极材料本身失电子被氧化.其氧化产物为Al2O3.由此可得阳极反应式为2Al+3H2O===Al2O3+6H++6e-.加入NaHCO3溶液后.Al3+与HCO发生水解相互促进反应.离子方程式可表示为Al3++3HCO===Al(OH)3↓+3CO2↑. (2)电镀时若用石墨作阳极.则电解过程中电解液中Cu2+浓度不断减小.导致铁表面不能镀上均匀的铜. (3)若X为碳棒.则只能用外加电源的阴极保护法.此时开关K应置于N处.若X为Zn.K置于M处.其保护原理称为牺牲阳极的阴极保护法. 答案:(1)①2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑(或:2Al+2OH-+2H2O===2AlO+3H2↑) b ②2Al+3H2O===Al2O3+6H++6e- HCO与H+反应使H+的浓度减小.产生Al(OH)3沉淀 (2)补充溶液中消耗的Cu2+.保持溶液中Cu2+浓度恒定 (3)N 牺牲阳极的阴极保护法
网址:http://m.1010jiajiao.com/timu3_id_84781[举报]
工业上采用如图所示电解装置制取活泼金属铝,由于阳极产生的氧气全部与石墨电极反应生成CO和CO2气体,因此在电解过程中碳电极需要不断补充.已知电解总反应方程式为:2Al2O3
4Al+3O2↑.

(1)阴极反应式为
(2)若生产中每生成a gAl,阳极损失石墨bg,则理论上产生CO和CO2的物质的量分别是
(3)对金属制品进行抗腐蚀处理,可延长其使用寿命.以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为
查看习题详情和答案>>
| ||

(1)阴极反应式为
4Al3++12e-=4Al
4Al3++12e-=4Al
;阳极反应式为6O2--12e-=3O2↑
6O2--12e-=3O2↑
.(2)若生产中每生成a gAl,阳极损失石墨bg,则理论上产生CO和CO2的物质的量分别是
CO:
mol、CO2:
mol
| 3b-a |
| 18 |
| 2a-3b |
| 36 |
CO:
mol、CO2:
mol
.| 3b-a |
| 18 |
| 2a-3b |
| 36 |
(3)对金属制品进行抗腐蚀处理,可延长其使用寿命.以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为
2Al+3H2O=Al2O3+6H++6e-
2Al+3H2O=Al2O3+6H++6e-
.(2010?山东)对金属制品进行抗腐蚀处理,可延长其使用寿命.
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4 溶液中电解,铝材表面形成氧化膜,阳极电极反应为
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是
(3)利用图装置,可以模拟铁的电化学防护.

若X为碳棒,为减缓铁的腐蚀,开关K应置于
若X为锌,开关K置于M处,该电化学防护法称为
查看习题详情和答案>>
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是
2Al+2OH-+2H2O═2AlO2-+3H2↑;
2Al+2OH-+2H2O═2AlO2-+3H2↑;
(用离子方程式表示).为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的b
b
.a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4 溶液中电解,铝材表面形成氧化膜,阳极电极反应为
2Al+3H2O-6e-═Al2O3+6H+
2Al+3H2O-6e-═Al2O3+6H+
.取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀
HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀
.(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是
阳极Cu可以发生氧化反应生成Cu2+
阳极Cu可以发生氧化反应生成Cu2+
.(3)利用图装置,可以模拟铁的电化学防护.

若X为碳棒,为减缓铁的腐蚀,开关K应置于
N
N
处.若X为锌,开关K置于M处,该电化学防护法称为
牺牲阳极保护法
牺牲阳极保护法
. 铁、铝是现代金属材料的主角.
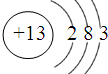
铁、铝是现代金属材料的主角.(1)写出Al的原子结构示意图

3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O
3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O
;(2)已知:铝的燃烧热为1675kJ?mol-1;2Fe(s)+3/2O2(g)═Fe2O3(s);△H=-822kJ?mol-1;则2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s);△H=
-2528KJ/mol
-2528KJ/mol
;(3)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
N
N
处(填“M”或“N”).若X为锌,开关K置于M处,则此时铁棒上发生的电极反应方程式为O2+4e-+2H2O═4OH-
O2+4e-+2H2O═4OH-
;(4)对金属制品进行抗腐蚀处理,可延长其使用寿命.铁制品表面镀铜可防止其腐蚀,电镀时为了补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定,则阳极材料必须为
Cu
Cu
. 金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.
金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.(1)在进行电解前,要对铝电极进行表面处理,是将铝片浸入热的16%NaOH溶液中半分钟左右,目的是
(2)以铝片为阳极,在H2SO4溶液中电解,取少量废电解液,加入NaHCO3溶解后产生气泡和白色沉淀,产生沉淀的原因是
(3)在金属表面形成一薄层有抗腐蚀、抗磨损能力的金属镀膜.例如在铝片上电镀铜时,电解原理是采用Cu(NO3)2溶液为电解质,用作阳极.而在实际的电镀工艺中,要求控制金属在镀件上的析出速率,使析出的镀层厚度均匀、光滑致密、与底层金属的附着力强.所以电镀铜时,实际使用的电镀液是
a.AlCl3
b.CuCl2
c.K6[Cu(P2O7)2]
d.CuSO4
(4)在如图所示装置中,溶液的体积为100mL,开始时电解质溶液的浓度为0.1mol/L,工作一段时间后导线上通过0.001mol电子.若不考虑盐的水解和溶液体积的变化,则电解后溶液的pH为
铝是用途广泛的金属
(1)对金属制品进行抗腐蚀处理,可延长其使用寿命.以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是(用离子方程式表示)
A.NH3 B.CO2 C.NaOH D.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为
(2)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:

①流程甲加入盐酸后生成Al3+的离子方程式为
②滤液E、K中溶质的主要成份是
查看习题详情和答案>>
(1)对金属制品进行抗腐蚀处理,可延长其使用寿命.以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是(用离子方程式表示)
2Al+2OH-+2H2O═2AlO+3H2↑
2Al+2OH-+2H2O═2AlO+3H2↑
.为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的b
b
.A.NH3 B.CO2 C.NaOH D.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为
2Al+3H2O-6e-═Al2O3+6H+
2Al+3H2O-6e-═Al2O3+6H+
删除此空
删除此空
.取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的离子方程式是3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
(2)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:

①流程甲加入盐酸后生成Al3+的离子方程式为
Al2O3+6H+═2Al3++3H2O
Al2O3+6H+═2Al3++3H2O
.②滤液E、K中溶质的主要成份是
NaHCO3
NaHCO3
(填化学式),写出该溶液的一种用途制纯碱或做发酵粉等
制纯碱或做发酵粉等
.