5.(2010·崇文模拟)A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.
|
元素 |
原子结构或性质 |
|
A |
原子最外层电子数是内层电子总数的1/5 |
|
B |
形成化合物种类最多的元素,其单质为固体 |
|
C |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
|
D |
地壳中含量最多的元素 |
|
E |
与D同主族 |
|
F |
与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是___________________;A与E形成的化合物的电子式是________________.
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是________________________________________________________________________________________________________________________________________________.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是_____
________________________________________________________________________.
(4)F的盐酸盐水溶液呈酸性,原因是_____________________________________(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式:__________________________________________________________________.
解析:由题给信息推出A为Mg元素;B为C元素;C为Fe元素;D为O元素;E为S元素;F为Al元素.
(1)A(Mg元素)在周期表中位于第三周期ⅡA族,A与E形成的化合物的电子式为Mg2+ .
.
 (2)FeCl3的浓溶液腐蚀铜的离子方程式为:2Fe3++Cu===2Fe2++Cu2+.(3)C与水反应的化学方程式为:C+H2O(g)CO+H2.(4)AlCl3溶液呈酸性是因为Al3+的水解,离子方程式为Al3++3H2O
(2)FeCl3的浓溶液腐蚀铜的离子方程式为:2Fe3++Cu===2Fe2++Cu2+.(3)C与水反应的化学方程式为:C+H2O(g)CO+H2.(4)AlCl3溶液呈酸性是因为Al3+的水解,离子方程式为Al3++3H2O Al(OH)3+3H+;C、D形成的相对分子质量为160的化合物为Fe2O3,则发生铝热反应的化学方程式为2Al+Fe2O32Fe+Al2O3.
Al(OH)3+3H+;C、D形成的相对分子质量为160的化合物为Fe2O3,则发生铝热反应的化学方程式为2Al+Fe2O32Fe+Al2O3.
答案:(1)第3周期ⅡA族 Mg2+
(2)2Fe3++Cu===2Fe2++Cu2+
(3)C+H2O(g)CO+H2
(4)Al3++3H2O Al(OH)3+3H+ 2Al+Fe2O32Fe+Al2O3
Al(OH)3+3H+ 2Al+Fe2O32Fe+Al2O3
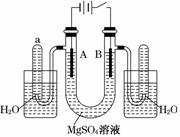
 ________________________________;
________________________________;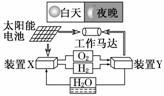 (2010·江苏高考)右图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
(2010·江苏高考)右图是一种航天器能量储存系统原理示意图.下列说法正确的是( )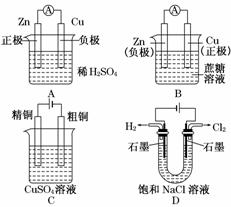

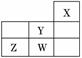 (2010·西城模拟)短周期元素W、X、Y、Z在元素周期
(2010·西城模拟)短周期元素W、X、Y、Z在元素周期 表中的位置如
表中的位置如