12.根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列各题:
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2 080 |
4 000 |
6 100 |
9 400 |
|
R |
500 |
4 600 |
6 900 |
9 500 |
|
S |
740 |
1 500 |
7 700 |
10 500 |
|
T |
580 |
1 800 |
2 700 |
11 600 |
|
U |
420 |
3 100 |
4 400 |
5 900 |
(1)在周期表中,最可能处于同一族的是________。
A.Q和R B.S和T
C.T和U D.R和T
E.R和U
(2)下列离子的氧化性最弱的是________。
A.S2+ B.R2+
C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是____。
A.硼 B.铍
C.氦 D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明:__________________________,如果U元素是短周期元素,你估计它的第2次电离能飞跃数据将发生在失去第________个电子时。
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________,其中元素________的第一电离能异常高的原因是________________________________________________________________________
________________________________________________________________________。
[解析] (1)由表中数据知,R和U的第一至第四电离能变化规律相似,即R和U最可能在同一主族。
(2)离子的氧化性最弱,即其对应的电离能最小。由表中数据看出U的第一电离能为420 kJ·mol-1,数值最小。
(3)Q元素各电离能都较大,而且各电离能之间无太大差距,故Q最可能为稀有气体元素。
(4)相邻两个电离能数据相差较大,从一个侧面说明电子是分层排布的,且各能层能量不同。若U为短周期元素,据表中数据第一次电离能飞跃是失去第2个电子时,可推知U在ⅠA族,则第二次电离能飞跃是在失去第10个电子时发生的。
(5)R元素第二电离能有较大飞跃,S元素第三电离能有较大飞跃,T元素第四电离能有较大飞跃,由题意知三者为同周期三种主族元素,可推知R在ⅠA族,S在ⅡA族,T在ⅢA族,故原子序数R<S<T,由表中数据知S元素的电离能异常高,其原因是S元素的最外层电子处于s能级全充满状况,能量较低,比较稳定,失去一个电子吸收的能量较多。
[答案] (1)E (2)D (3)C
(4)电子分层排布,各能层能量不同 10
(5)R<S<T S S元素的最外层电子处于s能级全充满状态,能量较低,比较稳定,失去一个电子吸收的能量较多
 CH2 ③CH
CH2 ③CH CH ④NH3 ⑤NH4+
CH ④NH3 ⑤NH4+ CH2的中心原子为sp2杂化,分别为平面三角形、平面形。CH
CH2的中心原子为sp2杂化,分别为平面三角形、平面形。CH CH中心原子为sp杂化,直线形。存在配位键的为NH4+,结构式为
CH中心原子为sp杂化,直线形。存在配位键的为NH4+,结构式为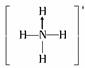 。
。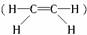 分子中,C--H键是极性键,C==C键是非极性键。
分子中,C--H键是极性键,C==C键是非极性键。
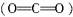 是非极性分子,分子中所有化学键都是极性键,故C也是错误的。
是非极性分子,分子中所有化学键都是极性键,故C也是错误的。
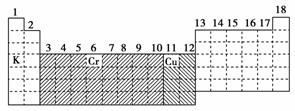
 和
和 表示d区和ds区。
表示d区和ds区。