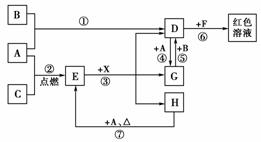
16.某校化学实验活动小组通过实验来探究一包黑色粉末是氧化铜、氧化亚铁或二者的混合物,探究过程如下:
(1)提出假设
假设1,黑色粉末是FeO;
假设2,黑色粉末是____________(写化学式);
假设3,黑色粉末是____________(写化学式)。
(2)设计探究实验。
实验小组选用稀硫酸、氯水、硫氰化钾溶液做试剂进行实验,请将实验操作步骤及现象填入下表。
|
实验操作 |
实验现象 |
实验结论 |
|
取少量粉末加入足量稀硫酸 |
|
假设1成立 |
|
|
|
假设2成立 |
|
|
假设3成立 |
(注意:假设2、假设3的现象应与假设相对应)
(3)经过实验及分析,确定该黑色物质为氧化铜和氧化亚铁的混合物。实验小组欲利用该黑色粉末制取较纯净的硫酸铜,通过查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3。实验小组设计了如下实验方案:
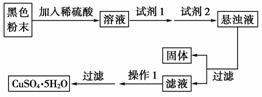
试回答:试剂1为__________,试剂2为__________(填字母),固体X的化学式是__________;操作1的名称为________。
[解析] 当黑色物质溶于稀H2SO4,且得到溶液显浅绿色,便可证明该黑色物质是FeO;当黑色粉末溶于稀H2SO4得蓝色溶液,再向其中滴入KSCN溶液,无明显变化,再加入Cl2水溶液若呈血红色可证明黑色物质是CuO和FeO混合物,若溶液仍呈蓝色,可证明黑色物质是CuO。
以CuO和FeO混合物为原料制CuSO4,首要任务是除去杂质。根据题设条件的路线,试剂1应为H2O2,以便将Fe2+氧化为Fe3+,并避免引入新杂质,然后用Cu2(OH)2CO3调pH,使Fe3+形成Fe(OH)3沉淀,过滤将滤液蒸发、浓缩、冷却结晶便可得到纯净的CuSO4·5H2O。
[答案] (1)CuO CuO和FeO
(2)
|
实验操作 |
实验现象 |
实验结论 |
|
|
黑色粉末完全溶解得浅绿色溶液 |
|
|
取少量粉末加足量稀H2SO4加几滴KSCN溶液再加几滴氯水 |
只得蓝色溶液 |
|
|
先形成蓝色溶液最后得血红色溶液 |
|
(3)B D Fe(OH)3 蒸发