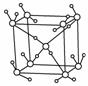
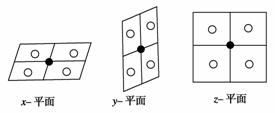
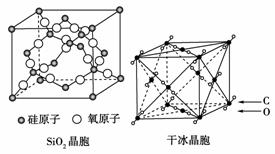
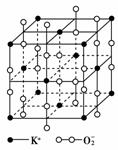
3.下表给出几种氯化物的熔点和沸点:
|
|
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
|
熔点/°C |
801 |
714 |
190 |
-70 |
|
沸点/°C |
1 413 |
1 412 |
180 |
57.57 |
有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时能升华,②四氯化硅在晶态时属于分子晶体,③氯化钠晶体中微粒之间以范德华力结合,④氯化铝晶体是典型的离子晶体。其中与表中数据一致的是( )
A.①② B.②
C.①②④ D.②④
[解析] 氯化铝的熔、沸点都很低,其晶体应该是分子晶体,并且沸点比熔点还低,加热时容易升华;四氯化硅是共价化合物,并且熔、沸点很低,应该属于分子晶体;氯化钠是离子晶体。
[答案] A
9.(2009年宁夏高考有改动)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为____________________,该元素的符号是________;
(2)Y元素原子的价层电子的轨道表示式为________________,该元素的名称是________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为__________;
(4)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
[解析] (1)因为X原子4p轨道上有3个未成对电子,可知其电子排布式为:1s22s22p63s23p63d104s24p3并推出其元素符号为As。
(2)根据Y元素的最外层2p轨道上有2个未成对电子,Y和Z元素的原子序数之和为42-33=9,Y可能为1s22s22p2或1s22s22p4,再根据Z可形成负一价离子,推出Y电子排布为后者,电子排布图为
|
↑↓ |
2s
|
↑↓ |
↑ |
↑ |
2p
,元素名称为氧。Z为氢。
(3)X与Z形成的化合物为AsH3,其空间构型可类比同主族的氢化物NH3,为三角锥形。
(4)氢化物的稳定性和元素的非金属性有关,或与共价键的键长有关。键长越短,键能越大,氢化物越稳定。所以NH3>PH3>AsH3。
[答案] (1)1s22s22p63s23p63d104s24p3 As
(2)
|
↑↓ |
2s
|
↑↓ |
↑ |
↑ |
2p
或
|
↑↓ |
2s
|
↑↓ |
↑ |
↑ |
2p
氧
(3)三角锥形
(4)稳定性:NH3>PH3>AsH3,因为键长越短,键能越大,化合物越稳定。
沸点:NH3>AsH3>PH3,NH3可以形成分子间氢键,沸点最高;AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3的沸点比PH3高