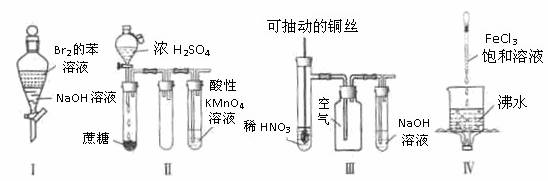
10.(2011四川)下列实验“操作和现象”与“结论”对应关系正确的是
|
|
操作和现象 |
结论 |
|
A |
向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 |
HNO3分解生成了NO2 |
|
B |
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成。 |
淀粉没有水解成葡萄糖 |
|
C |
向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去
。 |
使溶液褪色的气体是乙烯 |
|
D |
向饱和Na2CO3中通入足量CO2 ,溶液变浑浊 |
析出了NaHCO3 |
解析:在酸性溶液中NO3-具有氧化性,被Fe2+还原成NO气体,NO气体在管口遇空气氧化成NO2;没有加碱中和酸,不能说明是否水解;无水乙醇中加入浓H2SO4加热时有可能发生氧化还原反应生成二氧化硫气体,所以不一定是乙烯。
答案:D
7.(2011天津)向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
|
|
操作 |
现象 |
结论 |
|
A |
滴加BaCl2溶液 |
生成白色沉淀 |
原溶液中有SO42- |
|
B |
滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
|
C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+,无K+ |
|
D |
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
解析:能与BaCl2溶液反应生成白色沉淀的除了so42-以外,还可以是SO32-、CO32-、以及Ag+等,因此选项A不正确;CCl4的密度大于水的,而单质碘易溶在有机溶剂中,溶液显紫色说明有单质碘生成,所以只能是原溶液中的I-被氯水氧化成单质碘的,即选项B正确;因为在观察钾元素的焰色反应时,需要透过蓝色的钴玻璃滤去黄光,而在实验中并没有通过蓝色的钴玻璃观察,所以不能排除K+,选项C不正确;由于氨气极易溶于水,因此如果铵盐和强碱在稀溶液中反应且不加热时,产生的氨气不会挥发出来,红色石蕊试纸就不会变蓝色,所以选项D也不正确。
答案:B
5.(2011安徽高考10)下列有关实验操作、现象和解释或结论都正确的是
|
选项 |
实验操作 |
现象 |
解释或结论 |
|
A |
过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 |
溶液呈红色 |
稀HNO3将Fe氧化为Fe3+ |
|
B |
Agl沉淀中滴入稀KCl溶液 |
有白色沉淀出现 |
AgCl比Agl更难溶 |
|
C |
Al箔插入稀HNO3中 |
无现象 |
Al箔表面被HNO3氧化,形成致密的氧化膜 |
|
D |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上 |
试纸变蓝色 |
浓氨水呈碱性 |
解析:Fe粉与稀硝酸反应生成物是Fe3+,但过量的铁会继续和Fe3+反应,将其还原成Fe2+,即溶液中不存在Fe3+,所以滴入KSCN溶液不可能显红色,A不正确;AgI的溶度积常数小于AgCl的溶度积常数,所以Agl沉淀中滴入稀KCl溶液不可能产生AgCl沉淀,B不正确;Al箔插入稀HNO3中,首先硝酸会和Al箔表面的氧化膜反应,然后再和单质铝发生氧化还原反应,硝酸被还原生成NO气体单质铝表面的氧化膜是被空气中氧气氧化的,所以C也不正确;氨水在溶液中会电离出氢氧根离子而显碱性,当遇到红色石蕊试纸时会显蓝色,因此只有选项D正确。
答案:D
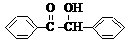 +2FeCl3
+2FeCl3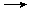
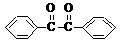 +2FeCl2+2HCl
+2FeCl2+2HCl