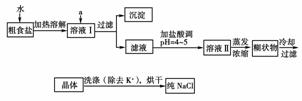
15.某校进行化学实验考查时,老师给了同学们一小包黑色粉末,这种黑色粉末可能是氧化铜、炭粉或者是这两种物质的混合物,让他们通过实验探究来确定。某同学探究过程如下:
(1)提出假设:
假设1:黑色粉末是炭粉;
假设2:______________________________;
假设3:________________________________________________________________________。
(2)设计实验方案:
他对实验做了如下设想和分析:取少量黑色粉末于烧杯中,并加入过量的稀H2SO4,则实验中可能出现的现象与对应结论如下表,请你完成下表。
|
实验中可能出现的现象 |
结论 |
|
① |
假设1成立 |
|
② |
|
|
③ |
假设3成立 |
(3)进行实验:
通过实验及分析,确定该黑色物质为炭粉和氧化铜的混合物。
(4)拓展:
为了进一步探究炭粉和氧化铜的性质,他又利用这种混合物补充做了如下实验,将此黑色粉末隔绝空气加热(若炭完全反应),待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完成后,静置。请你回答:
①烧杯中________(填“有”或“无”)不溶物。
②若静置后溶液呈无色,则该溶液中溶质是________(写化学式)。
③若静置后溶液呈蓝色,该反应的化学方程式为:________________________________________________________________________。
[解析] (1)一定要联系题中给出的黑色物质的可能性,由此提出你的猜想或假设,两种物质的三种组合。解答(2)(4),即设计实验方案验证你的三个假设,必须要了解木炭、氧化铜、稀硫酸的性质及相互反应的规律和能否反应呈现出不同现象。木炭与稀硫酸不反应,黑色的木炭不会溶解消失;CuO+H2SO4===CuSO4+H2O反应发生,溶液会由无色变为蓝色;由上述知识不难对(2)作出解答。解答(4)时,一定要理解它的意义和探究实验的基本方法,还应注意到题中关键处的说明,如“隔绝空气加热(碳完全反应)”,应该认识此处有2CuO+C2Cu+CO2↑反应发生,此反应中,木炭反应消耗完了,一定没有,生成的铜一定有,氧化铜则不能确定,可能有也可能无。
[答案] (1)黑色粉末是氧化铜 黑色粉末是炭粉和氧化铜的混合物 (2)①无变化 ②溶液变蓝色,黑色粉末溶解 假设2成立 ③溶液变蓝色,仍有部分黑色不溶物
(4)①有 ②H2SO4
③CuO+H2SO4===CuSO4+H2O
13.某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”);
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(2)取溶液进行焰色反应,火焰呈黄色。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(4)通过上述实验仍无法确定的物质是________。
[解析] (1)混合物溶于水得无色溶液,说明原物质无CuSO4,因CuSO4溶液呈蓝色,白色沉淀则不确定。
(2)焰色反应呈黄色,说明原物质一定含有Na2SO4,因为只有Na+焰色反应为黄色,不能断定其他物质是否含有。
(3)白色沉淀加盐酸沉淀完全溶解并放出气体,说明原物质中一定有MgCO3,因能产生气体的只有MgCO3,而一定无Ba(NO3)2和AgNO3,因如有Ba(NO3)2或AgNO3,会与存在的Na2SO4反应生成BaSO4或Ag2SO4,加入盐酸时沉淀不会消失。
(4)仍不能确定的只有Al2(SO4)3。
[答案] (1)
|
无 |
CuSO4 |
溶液无色,而CuSO4溶液为蓝色 |
(2)
|
Na2SO4 |
无 |
钠的焰色反应呈黄色 |
(3)
|
MgCO3 |
Ba(NO3)2 |
|
AgNO3 |
MgCO3沉淀溶于盐酸,有气体放出;如有Ba(NO3)2,生成的BaSO4沉淀不溶于盐酸;如有AgNO3,生成的Ag2SO4沉淀在盐酸中不溶 |
(4)Al2(SO4)3