8.现有几组物质的熔点(℃)数据:
|
A组 |
B组 |
C组 |
D组 |
|
金刚石:3 550 |
Li:181 |
HF:-83 |
NaCl:801 |
|
硅晶体:1 410 |
Na:98 |
HCl:-115 |
KCl:776 |
|
硼晶体:2 300 |
K:64 |
HBr:-89 |
RbCl:718 |
|
二氧化硅:1 723 |
Rb:39 |
HI:-51 |
CsCl:645 |
据此回答下列问题:
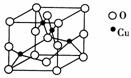
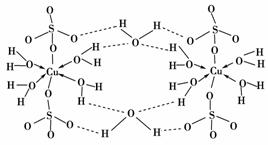
(1)A组属于________晶体,其熔化时克服的微粒间的作用力是________。
(2)B组晶体共同的物理性质是________(填序号)。
①有金属光泽 ②导电性
③导热性 ④延展性
(3)C组中HF熔点反常是由于________________________________________________________________________
________________________________________________________________________。
(4)D组晶体可能具有的性质是________(填序号)。
①硬度小 ②水溶液能导电
③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为:________________________________________________________________________
________________________________________________________________________
。
[解析] 通过读取表格中数据先判断出晶体的类型及晶体的性质,应用氢键解释HF的熔点反常,利用晶格能的大小解释离子晶体熔点高低的原因。
[答案] (1)原子 共价键 (2)①②③④ (3)HF分子间能形成氢键,其熔化时需要消耗的能量更多(只要答出HF分子间能形成氢键即可)
(4)②④ (5)D组晶体都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高
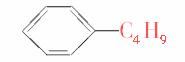 ,由于-C4H9有4种结构,又
,由于-C4H9有4种结构,又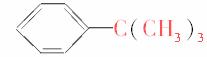 不能被酸性KMnO4氧化,故符合条件的烃有3种。
不能被酸性KMnO4氧化,故符合条件的烃有3种。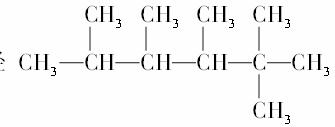 是烯烃R和氢气1∶1发生加成后的产物,则R可能的结构简式有( )
是烯烃R和氢气1∶1发生加成后的产物,则R可能的结构简式有( )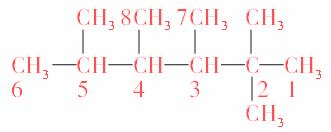
 或1个、
或1个、 ;又知生成的氯代烷1 mol 能和6 mol Cl2发生完全取代反应,可知该氯代烷分子中含有6个氢原子,则原链烃中有4个氢原子。据此可知符合题意的只有B。
;又知生成的氯代烷1 mol 能和6 mol Cl2发生完全取代反应,可知该氯代烷分子中含有6个氢原子,则原链烃中有4个氢原子。据此可知符合题意的只有B。 [解析] 乙烯基乙炔分子既有
[解析] 乙烯基乙炔分子既有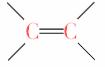 又有
又有 ,根据同系物概念,A错误;含不饱和键能使酸性KMnO4溶液褪色,也能使溴水褪色,B正确;该物质加氢后只生成正丁烷,C正确;D
,根据同系物概念,A错误;含不饱和键能使酸性KMnO4溶液褪色,也能使溴水褪色,B正确;该物质加氢后只生成正丁烷,C正确;D [答案] A
[答案] A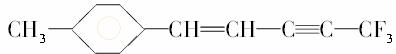 分子中最多可能有多少个原子共处于同一平面( )
分子中最多可能有多少个原子共处于同一平面( )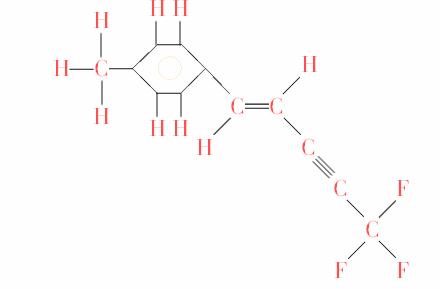
 分子的空间构型和-CH3(或-CF3)中的单键能旋转,即-CH3(或-CF3)上最多有2个原子(包括一个碳原子和一个氢原子)能落到题目提供的平面上。因此,最多可有20个原子共平面。
分子的空间构型和-CH3(或-CF3)中的单键能旋转,即-CH3(或-CF3)上最多有2个原子(包括一个碳原子和一个氢原子)能落到题目提供的平面上。因此,最多可有20个原子共平面。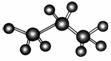
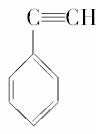 与C8H6互为同分异构体
与C8H6互为同分异构体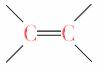 不能省略;④不正确,C8H6是一个分子式,不是一种具体物质;①正确;2,3-二甲基戊烷的结构简式为
不能省略;④不正确,C8H6是一个分子式,不是一种具体物质;①正确;2,3-二甲基戊烷的结构简式为