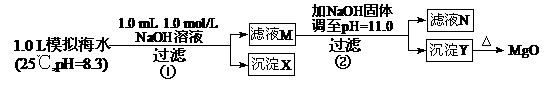
3.(2011浙江高考13)海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
|
模拟海水中的离 子浓度(mol/L) |
Na+ |
Mg2+ |
Ca2+ |
Cl― |
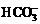 |
|
0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
解析:步骤①发生Ca2++OH―+
 CaCO3↓+H2O;步骤②:Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6。Q[Ca(OH)2]=c(Ca2+)×(10-3)2=10-8<Ksp,无Ca(OH)2析出。
CaCO3↓+H2O;步骤②:Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6。Q[Ca(OH)2]=c(Ca2+)×(10-3)2=10-8<Ksp,无Ca(OH)2析出。
A.正确。生成0001 mol CaCO3。
B.错误。剩余c(Ca2+)=0.001 mol/L。
C.错误。c(Mg2+)=5.6×10-6<10-5,无剩余,
D.错误。生成0.05 mol Mg(OH)2,余0.005 mol OH―,Q[Ca(OH)2]=0.01×0.0052=2.5×10-7<Ksp,无Ca(OH)2析出。
答案:A
[评析]本题考察方式很新颖,主要考察溶度积的计算和分析。解题时要能结合溶度积计算,分析推断沉淀是否产生,要求较高。
答案:BD
 H++CH3COO-,故稀释10倍,pH增加不到一个单位,A项错误;加入适量的醋酸钠固体,抑制醋酸的电离,使其pH增大,可以使其pH由a变成(a+1);B项正确;加入等体积0.2 mol·L-1盐酸,虽然抑制醋酸的电离,但增大了c(H+),溶液的pH减少;C项错误;提高溶液的温度,促进了醋酸的电离,c(H+)增大,溶液的pH减少;D项错误。
H++CH3COO-,故稀释10倍,pH增加不到一个单位,A项错误;加入适量的醋酸钠固体,抑制醋酸的电离,使其pH增大,可以使其pH由a变成(a+1);B项正确;加入等体积0.2 mol·L-1盐酸,虽然抑制醋酸的电离,但增大了c(H+),溶液的pH减少;C项错误;提高溶液的温度,促进了醋酸的电离,c(H+)增大,溶液的pH减少;D项错误。
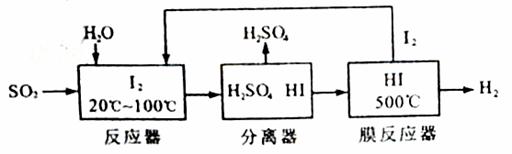
 Ni(OH)2+M
Ni(OH)2+M 2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol
2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol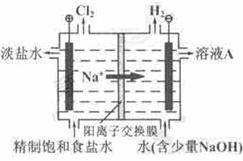
 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。 HCl+HClO,根据平衡移动原理可知增大盐酸的浓度可使平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的溢出。
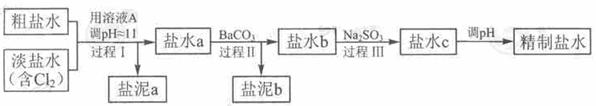
HCl+HClO,根据平衡移动原理可知增大盐酸的浓度可使平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的溢出。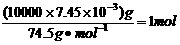 ,由方程式可知消耗Na2SO3的质量为1mol×126g/mol=126g。若设需要10% Na2SO3溶液的质量为X,则有
,由方程式可知消耗Na2SO3的质量为1mol×126g/mol=126g。若设需要10% Na2SO3溶液的质量为X,则有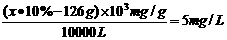 ,解得x=1760g,即至多添加10% Na2SO3溶液1.76kg。
,解得x=1760g,即至多添加10% Na2SO3溶液1.76kg。 Ag2O2↓+2KNO3+K2SO4+2H2O
Ag2O2↓+2KNO3+K2SO4+2H2O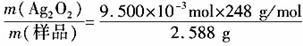 =0.91。
=0.91。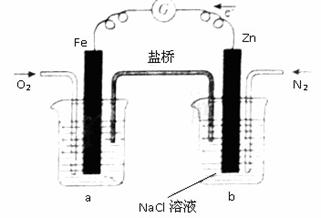
 -=H2
-=H2