10.如表是元素周期表的一部分,回答下列有关问题:(用元素符号填空)
|
族 |
|
|
|
|
|
|
|
|
|
周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
③ |
④ |
⑤ |
⑥ |
|
⑦ |
⑧ |
⑨ |
|
4 |
|
⑪ |
|
|
|
|
⑫ |
|
(1)写出下列元素符号及电子排布式:①______________,⑥____________,⑦____________,⑧____________。
(2)在①-⑧中电负性最大的元素是________,第一电离能最小的元素是________(填元素符号)。
(3)在这些元素中的最高价氧化物对应的水化物中,酸性最强的是________(填化学式,下同),碱性最强的是________,呈两性的氢氧化物是________,写出三者之间两两相互反应的离子方程式________________________________________________________________________
________________________________________________________________________。
(4)在这些元素中,原子半径最小的是________(填元素符号)。
[答案] (1)①N,[He]2s22p3 ⑥Si,[Ne]3s23p2
⑦S,[Ne]3s23p4 ⑧Cl,[Ne]3s23p5 (2)F Na
(3)HClO4 KOH Al(OH)3 H++OH-===H2O,3H++Al(OH)3===Al3++3H2O,OH-+Al(OH)3===AlO2-+2H2O(4)F
9.电离能是指1 mol气态原子(或阳离子)失去1 mol电子形成1 mol气态阳离子(或更高价阳离子)所需吸收的能量。现有核电荷数小于20的元素A,其电离能数据如下:(I1表示失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:kJ/mol)
|
序号 |
I1 |
I2 |
I3 |
I4 |
I5 |
I6 |
|
电离能 |
7.644 |
15.03 |
80.12 |
109.3 |
141.2 |
186.5 |
|
序号 |
I7 |
I8 |
I9 |
I10 |
I11 |
… |
|
电离能 |
224.9 |
266.0 |
327.9 |
367.4 |
1 761 |
… |
(1)外层电子离核越远,能量越高,电离能越________(填“大”或“小”);阳离子电荷数越高,再失去电子时,电离能越______(填“大”或“小”)。
(2)上述11个电子分属几个电子层?________。
(3)失去了11个电子后,该元素还有________个电子。
(4)该元素最高价氧化物对应水化物的化学式是____________。
[解析] 从表中可看出,电离能的绝对量是I1<I2<I3……但在此更应关注相对量,相邻两个电离能的相对量是:<2倍,>5倍,<2倍,…而>4倍,从相对量的变化说明I1、I2两个电子的排布与I3到I10八个电子的排布不同,而I11电子的排布又是另一回事,所以上述11个电子分属三个电子层,最外层有2个电子,次外层有8个电子,是镁元素。
[答案] (1)小 大 (2)3 (3)1 (4)Mg(OH)2
5.已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是( )
|
元素 |
I1 |
I2 |
I3 |
I4 |
|
X |
500 |
4 600 |
6 900 |
9 500 |
|
Y |
580 |
1 820 |
2 750 |
11 600 |
A.元素X的常见化合价是+1
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应
[解析] 由数据分析X中I2≫I1,X易呈+1价,为ⅠA族,所以A、C项均正确。Y中I4≫I3,易呈+3价,应在ⅢA族,B项正确。若Y处于第3周期,则Y为铝元素,Al不与冷水反应,D错。
[答案] D
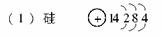
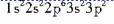
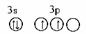

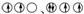 ,均为2个未成对电子,电子数为14或16。元素符号为Si、S。
,均为2个未成对电子,电子数为14或16。元素符号为Si、S。