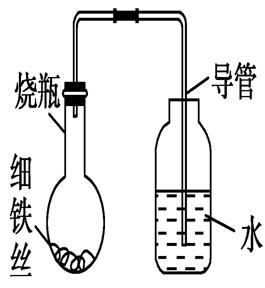
10.某学生在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝(并使铁丝完全浸没在食盐水中),然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示:
|
时间/小时 |
0 |
0.5 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
|
|
A瓶(盛干燥细铁丝) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
B瓶(盛浸过食盐水的细铁丝) |
0 |
0.4 |
1.2 |
3.4 |
5.6 |
7.6 |
9.8 |
|
|
C瓶(盛浸过清水的细铁丝) |
0 |
0 |
0 |
0.3 |
0.8 |
2.0 |
3.5 |
|
|
D瓶(盛完全浸没在食盐水中的细铁丝) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
(1)为什么有的导管中水面会上升?________________________________________________________________________
________________________________________________________________________。
(2)上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧瓶的字母编号)________________________________________________________________________。
(3)影响铁生锈的因素除氧气外,还有________________________________________________________________________。
(4)日常生活中常见到铁制品生成铁锈,试写出铁制品生成铁锈(Fe2O3·xH2O)的化学方程式________________________________________________________________________。
(5)通过以上研究你认为在日常生活中应如何保护铁制品?
________________________________________________________________________(至少回答两种方法)
[解析] 铁丝在食盐水中会形成原电池,负极反应为2Fe-4e-===2Fe2+;正极反应为2H2O+O2+4e-===4OH-,由于铁丝腐蚀过程中消耗了O2,使瓶内气体的物质的量减少,压强减小,致使导管中水面上升,产生的Fe2+和OH-结合成Fe(OH)2:Fe2++2OH-===Fe(OH)2,Fe(OH)2进一步氧化生成Fe(OH)3:4Fe(OH)2+O2+2H2O===4Fe(OH)3,2Fe(OH)3===Fe2O3+3H2O,从而形成铁锈。
[答案] (1)氧气消耗后,瓶内气体物质的量减少,导致瓶内压强减小,因此导管中水面上升
(2)B>C>A=D
(3)水、电解质(或电解质溶液)
(4)4Fe+3O2+2xH2O===2Fe2O3·xH2O
(5)洗净擦干涂油;与较活泼的金属锌用导线连接;将铁制品置于通风干燥处,避免将其置于潮湿处等
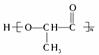 具有良好的生物适应性,能在自然界中自行降解,回答:
具有良好的生物适应性,能在自然界中自行降解,回答: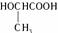 醇羟基、羧基
醇羟基、羧基