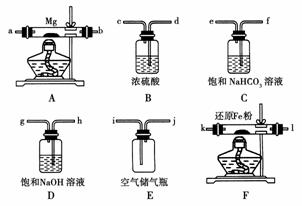
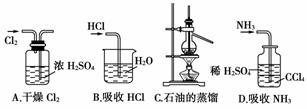
10.(2007年广东)下述实验能达到预期目的的是
( )
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有氧化性 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯与溴的氧化性强弱 |
|
C |
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 |
研究温度对化学平衡的影响 |
|
D |
分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对H2O2分解速率的影响 |
[解析] A项在该反应中,SO2体现还原性;D项两种溶液浓度不同,H2O2分解速率不同,到底是催化剂还是浓度的影响说不清楚。
[答案] BC

 △,2MgO;②3Mg+N2
△,2MgO;②3Mg+N2