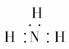13.(2008年上海)如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。

|
实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
|
1 |
10 mL FeSO4溶液 |
10 mL NH3 |
生成白色沉淀,后变色 |
|
2 |
20 mL H2S |
10 mL SO2 |
|
|
3 |
30 mL NO2(主要) |
10 mL H2O(l) |
剩有无色气体,活塞自动向内压缩 |
|
4 |
15 mL Cl2 |
40 mL NH3 |
|
请回答下列问题:
(1)实验1中,沉淀最终变为________色,写出沉淀变色的化学方程式________________________________________________________________________。
(2)实验2甲针筒内的现象有:有________生成,活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入________溶液中。
(3)实验3中,甲中的30 mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是________,写出NO2与H2O反应的化学方程式_______________________________
________________________________________________________________________。
(4)实验4中,已知:3Cl2+2NH3―→N2+6HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为________________,最后针筒内剩余气体的体积约为________mL。
[解析] 在(2)中实验2发生的反应为:2H2S+SO2===3S↓+2H2O,二者反应有单质硫生成,同时气体几乎完全消失。在(3)中随着NO2与水不断反应,N2O4会逐渐转化为NO2并最终完全与水反应生成HNO3和NO。在(4)中有白烟产生是因为过量的NH3与HCl反应生成了NH4Cl,最终针筒里的气体只有N2。
[答案] (1)红褐 4Fe(OH)2+O2+2H2O===4Fe(OH)3
(2)黄色固体 向内 NaOH
(3)NO 3NO2+H2O===2HNO3+NO
(4)黄绿色变为无色 5
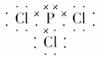 各原子最外层均为8电子结构,所以丁为PCl5。
各原子最外层均为8电子结构,所以丁为PCl5。

 NH+OH- (3)PCl5 (4)P3N3Cl6
NH+OH- (3)PCl5 (4)P3N3Cl6