11.铁及铁的化合物应用广泛,如FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是
________________________________________________________________________。
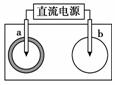
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应________________,负极反应__________________。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤_______________
________________________________________________________________________。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
Fe2+ |
||
|
Cu2+ |
||
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式____________________________________________________
________________________________________________________________________。
劣质不锈钢腐蚀的实验现象________________________________________________。
[解析] (1)该反应是FeCl3氧化金属铜,离子方程式为2Fe3++Cu===2Fe2++Cu2+
(2)将(1)中反应设计成原电池必须是Cu作负极,选择比铜不活泼的金属或碳棒为正极,FeCl3溶液作电解质溶液。装置图如右图所示:
正极:2Fe3++2e-===2F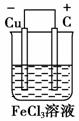 e2+
e2+
负极:Cu-2e-===Cu2+
(3)根据表给出的数据可知,把Cu2+中混有的Fe2+、Fe3+除掉的方法是将Fe2+氧化为Fe3+,调节溶液的pH到3.2-4.7,Fe3+以Fe(OH)3的形式沉淀,过滤除去,根据除杂原则,去杂不能加杂,选择氧化剂为Cl2,加入CuO调节溶液的pH。
(4)根据题给条件,此不锈钢在盐溶液中腐蚀明显,可选择的药品为CuO、浓H2SO4,先用水稀释浓H2SO4再用H2SO4与CuO反应生成CuSO4溶液,不锈钢与CuSO4溶液反应,在不锈钢的表面有紫红色物质生成,即可验证劣质不锈钢易被腐蚀。
[答案] (1)2Fe3++Cu===2Fe2++Cu2+
(2)装置图如下
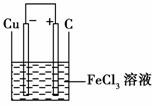
正极反应:Fe3++e-===Fe2+(或2Fe3++2e-===2Fe2+)
负极反应:Cu===Cu2++2e-(或Cu-2e-===Cu2+)
(3)①通入足量氯气将Fe2+氧化成Fe3+;
②加入CuO调节溶液的pH至3.2-4.7;
③过滤[除去Fe(OH)3]
(4)CuO+H2SO4===CuSO4+H2O
CuSO4+Fe===FeSO4+Cu
不锈钢表面有紫红色物质生成
21.(12分)蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下图所示
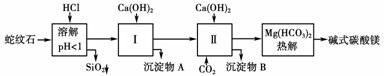
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________________。
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见上表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致______溶解、________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入________(填入物质的化学式),然后____________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是____________________(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③________________________________________________
④____________________________ ⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:a=____________________,b=________________,c=______________。
[解析] (1)四种氧化物中只有SiO2不溶于盐酸。MgO+2HCl===MgCl2+H2O;Fe2O3+6HCl===2FeCl3+3H2O,Al2O3+6HCl===2AlCl3+3H2O。
(2)由沉淀表可知控制pH=7-8时,Fe3+、Al3+均与Ca(OH)2生成Fe(OH)3、Al(OH)3。若Ca(OH)2过量,碱性增强,pH>9.4时,Mg2+会变为Mg(OH)2沉淀,而又会发生Al(OH)3+OH-===AlO+2H2O使Al(OH)3溶解。
(3)沉淀物A为Fe(OH)3与Al(OH)3,由其性质可知,要分离出红色氧化物颜料为Fe2O3,则需加过量NaOH,将Al(OH)3溶解,然后依据固液分离和固体灼烧的方法回答,发生2Fe(OH)3Fe2O3+3H2O反应而得。
(4)Ⅱ中生成的沉淀B为CaCO3,高温煅烧可生成CO2,2Mg(HCO3)2Mg2(OH)2CO3+3CO2↑+H2O也产生CO2,可循环利用。
(5)见答案
(6)据元素守恒可知:n(CO2)=n(MgCO3)==0.15 mol。镁元素守恒可知:n[Mg(OH)2]=n(MgO)-n(MgCO3)=-0.15 mol=0.05 mol。根据前后质量守恒可求n(H2O)=0.15 mol,则a∶b∶c=3∶1∶3,即为最小整数比,可得。
[答案] (1)Fe3+、Al3+
(2)Al(OH)3 Mg(OH)2
(3)NaOH或Ca(OH)2 过滤、洗涤、灼烧
(4)CaCO3或CO2
(5)③用浓硫酸吸收水蒸气 ④称量碱石灰吸收CO2前后的质量 (6)3 1 3