23.(2010福建卷)(15分)
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的物质的量 |
加入甲的物质的量 |
|
y |
甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215k J。
该反应的热化学方程式为________。
J。
该反应的热化学方程式为________。
解析:
(1) J元素最低负化合价的绝对值与其原子最外层电子数相等,可以判断J元素为碳元素;M是地壳中含量最多的金属元素为铝元素;根据J、R在周期表中的相对位置可以判断R为硫元素,则T为氯元素,处于第三周期第七主族
(2)J和氢组成含有6个原子的分子为乙烯,其结构简式为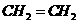
(3)M和T形成的化合物为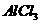 ,与水反应
,与水反应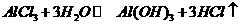 ,其中氯化氢气体呈雾状
,其中氯化氢气体呈雾状
(4)①氨水与双氧水发生氧化还原反应: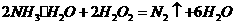
生成无污染的氮气;
②甲在固体体积的密闭容器中发生分解反应 ,
, 表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入
表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入 的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
(5)JR2为CS2,燃烧生成二氧化碳和二氧化硫,依题意可以很快的写出反应的热化学方程式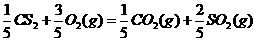
答案:(1)  ;
ⅦA
;
ⅦA
(2)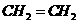
(3)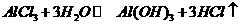 ,
,
(4)①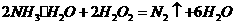
②a和c;a或c
(5)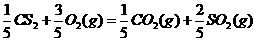
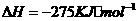
10.(2010天津卷)(14分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 煤的气化的主要化学反应方程式为:___________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) +
CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g)
 CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) +
3CO(g)  CH3OCH3(g)
+ CO2 (g)的ΔH= ___________;
CH3OCH3(g)
+ CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g)  CH3OCH3(g)
+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)
+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
解析:(1)煤生成水煤气的反应为C+H2O CO+H2。
CO+H2。
(2)既然生成两种酸式盐,应是NaHCO3和NaHS,故方程式为:
Na2CO3+H2S==NaHCO3+NaHS。
(3)观察目标方程式,应是①×2+②+③,故△H=2△H1+△H2+△H3=-246.4kJ· mol -1。
正反应是放热反应,升高温度平衡左移,CO转化率减小;加入催化剂,平衡不移动,转化率不变;减少CO2的浓度、分离出二甲醚,平衡右移,CO转化率增大;增大CO浓度,平衡右移,但CO转化率降低;故选c、e。
(4)此时的浓度商Q=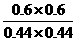 =1.86<400,反应未达到平衡状态,向正反应方向移动,故
=1.86<400,反应未达到平衡状态,向正反应方向移动,故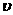 正>
正>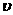 逆;设平衡时生成物的浓度为0.6+x,则甲醇的浓度为(0.44-2x)有:400=
逆;设平衡时生成物的浓度为0.6+x,则甲醇的浓度为(0.44-2x)有:400= ,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。
,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。
由表可知,甲醇的起始浓度度为(0.44+1.2) mol·L-1=1.64 mol·L-1,其平衡浓度为0.04 mol·L-1,
10min变化的浓度为1.6 mol·L-1,故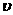 (CH3OH)=0.16
mol·L-1·min-1。
(CH3OH)=0.16
mol·L-1·min-1。
答案:(1) C+H2O CO+H2。
CO+H2。
(2) Na2CO3+H2S==NaHCO3+NaHS
(3) -246.4kJ· mol -1 c、e
(4) ①> ②0.04 mol·L-1 0.16 mol·L-1·min-1
命题立意:本题是化学反应原理的综合性试题,考查了化学方程式的书写、盖斯定律的应用、化学平衡移动原理,和利用浓度商和平衡常数的关系判断平衡移动的方向、平衡常数和速率的计算等。
14.(2010江苏卷)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知
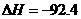 kJ·mol
kJ·mol )
)
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
NH3的浓度(mol·L ) ) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
反应物转化率 |
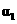 |
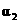 |
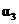 |
下列说法正确的是
A.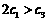 B.
B.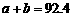 C.
C.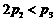 D.
D.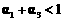
[答案]BD
[解析]本题主要考查的是化学平衡知识。A项,起始浓度不同,转化率也不同,不成倍数关系,B项,实际上为等同平衡,不同的是反应的起始方向不同,在此过程中乙吸收的热热量相当于甲完全转化需再放出的热量,故a+b=92.4;C项,通过模拟中间状态分析,丙的转化率小于乙,故2p2> p3;D项,a1+b1=1.,而a2> a3,所以a1+ a3<1.综上分析可知,本题选BD项。
(2010四川理综卷)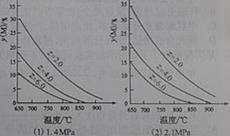 13.反应aM(g)+bN(g)
13.反应aM(g)+bN(g)  cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
A.同温同压Z时,加入催化剂,平衡时Q的体积分数增加
B.同压同Z时,升高温度,平衡时Q的体积分数增加
C.同温同Z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加Z,平衡时Q的体积分数增加。
答案:B
解析:本题考查了平衡移动原理的应用。A项加入催化剂只能改变反应速率,不会使平衡移动。B项由图像(1)知随着温度的升高M的体积分数降低,说明正反应吸热,所以温度升高平衡正向移动,Q的体积分数增加。C项对比(1)(2)可以看出相同温度条件,压强增大M的体积分数增大,所以正反应是体积缩小的反应,增大压强Q的体积分数减小。D项由C项可以判断D也不对。
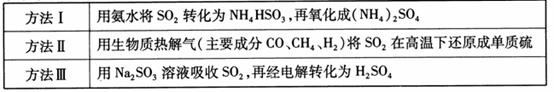
 的化学反应为:
的化学反应为: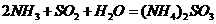
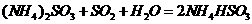
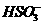 转化为
转化为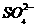
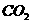 ,原因是▲(用离子方程式表示)。
,原因是▲(用离子方程式表示)。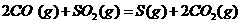
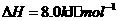
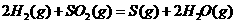
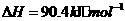
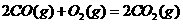
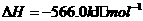
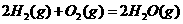
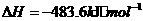
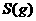 与
与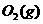 反应生成
反应生成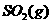 的热化学方程式为
。
的热化学方程式为
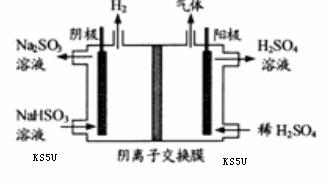
。 溶液的装置
溶液的装置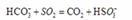

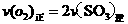 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化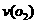 = mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方
= mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方 向”、“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。
向”、“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。 H2+I2
H2+I2
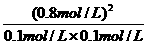 =64mol/L。
=64mol/L。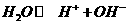 ,硫酸电离出的
,硫酸电离出的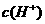 对水的电离是抑制作用,当
对水的电离是抑制作用,当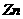 消耗了
消耗了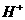 ,
,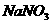 ,溶液变成
,溶液变成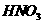 的溶液了,不再生成H2;加入的
的溶液了,不再生成H2;加入的 的加入对反应速率无影响;加入CuSO4 后,
的加入对反应速率无影响;加入CuSO4 后, =286
kJ,故该电池的能量转化率为
=286
kJ,故该电池的能量转化率为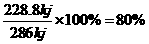
 )在不同温度下随反应时间(t)的变化见图12,由此图可得出:
)在不同温度下随反应时间(t)的变化见图12,由此图可得出: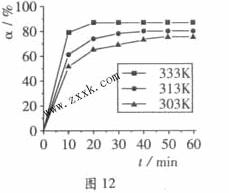
 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).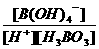 =
=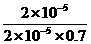 =
=
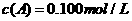 、
、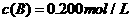 及
及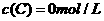 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。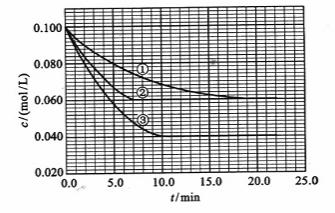
 =__________________________________;
=__________________________________; =__________________________________。
=__________________________________。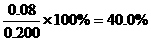 ;同样在③中A转化了0.06mol,则生成C为0.06mol,体积不变,即平衡时C(c)=0.06mol/L
;同样在③中A转化了0.06mol,则生成C为0.06mol,体积不变,即平衡时C(c)=0.06mol/L ,∴
,∴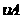 =0.014mol(L·min)-1;进行到4.0mi实验③的A的浓度为:0.064mol/L:△C(A,)
=0.10-0.064=0.036mol/L,
=0.014mol(L·min)-1;进行到4.0mi实验③的A的浓度为:0.064mol/L:△C(A,)
=0.10-0.064=0.036mol/L, ,∴
,∴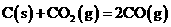 不能自发进行,则该反应的
不能自发进行,则该反应的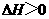
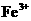 、
、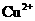 、
、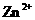 的氧化性依次减弱
的氧化性依次减弱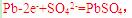 其质量在增加;B项
其质量在增加;B项 ,该反应是典型的吸热反应,在常温下不能自发进行;C项,催化剂能改变反应速率,不一定加快,同时它不能改变转化率;D项,
,该反应是典型的吸热反应,在常温下不能自发进行;C项,催化剂能改变反应速率,不一定加快,同时它不能改变转化率;D项,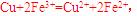 可知
可知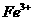 的氧化性大于
的氧化性大于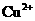 ,综上分析可知,本题选AC项。
,综上分析可知,本题选AC项。