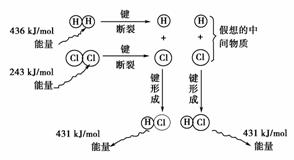
9.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
H-H |
Cl-Cl |
H-Cl |
|
生成1 mol 化学键时 放出的能量 |
436 kJ·mol-1 |
243 kJ·mol-1 |
431 kJ·mol-1 |
则下列热化学方程式不正确的是( )
A.H2(g)+Cl2(g)===HCl(g) ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1
C.H2(g)+Cl2(g)===HCl(g) ΔH=+91.5 kJ·mol-1
D.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ·mol-1
[解析] 本题考查反应热与键能的关系:ΔH=反应物键能总和-生成物键能总和。C项的反应是放热反应,C错误;ΔH=×436 kJ·mol-1-431 kJ·mol-1+×243 kJ·mol-1=-91.5 kJ·mol-1。
[答案] C