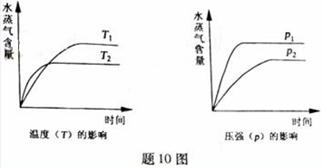
2.(2011江苏高考15)700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2+H2(g)
CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2):
|
反应时间/min |
n(CO)/mol |
H2O/
mol |
|
0 |
1.20 |
0.60 |
|
t1 |
0.80 |
|
|
t2 |
|
0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
[分析]本题属于基本理论中化学平衡问题,主要考查学生对速率概念与计算,平衡常数概念与计算,平衡移动等有关内容理解和掌握程度。高三复习要让学生深刻理解一些基本概念的内涵和外延。
A.反应在t1min内的平均速率应该是t1min内H2浓度变化与t1的比值,而不是H2物质的量的变化与t1的比值。
B.因为反应前后物质的量保持不变,保持其他条件不变,平衡常数不会改变,起始时向容器中充入0.60molCO和1.20 molH2O,似乎与起始时向容器中充入0.60molH2O和1.20 molCO效果是一致的,到达平衡时,n(CO2)=0.40 mol。
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大。
D.原平衡常数可通过三段式列式计算(注意浓度代入)结果为1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应。
答案:BC
 CO(NH2)2(s)+H2O(g); △H<0
CO(NH2)2(s)+H2O(g); △H<0
 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
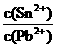 =0.22/0.10=2.2,故D项正确。
=0.22/0.10=2.2,故D项正确。 CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如下图所示。下列说法正确的是
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如下图所示。下列说法正确的是


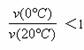 ,B不正确;根据图像可以看出当反应进行到66min时a、b曲线对应的转化分数均相同,都是0.113,这说明此时生成的CH3COCH2COH(CH3)2一样多,所以从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
,B不正确;根据图像可以看出当反应进行到66min时a、b曲线对应的转化分数均相同,都是0.113,这说明此时生成的CH3COCH2COH(CH3)2一样多,所以从Y=0到Y=0.113,CH3COCH2COH(CH3)2的 2
PbCrO4(s)+2H+(aq) ΔH< 0
2
PbCrO4(s)+2H+(aq) ΔH< 0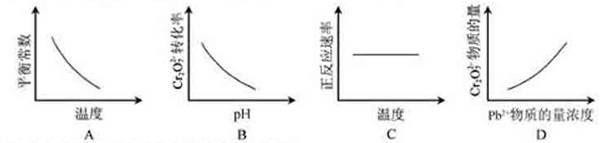
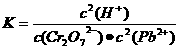 可知K应该减小,A正确;pH增大溶液碱性增强,会中和溶液中H+,降低生成物浓度平衡向正方应方向移动,Cr2O72-的转化率会增大,B不正确;温度升高,正、逆反应速率都增大,C错误;增大反应物Pb2+的浓度,平衡向正方应方向移动,Cr2O72-的物质的量会减小,D不正确。
可知K应该减小,A正确;pH增大溶液碱性增强,会中和溶液中H+,降低生成物浓度平衡向正方应方向移动,Cr2O72-的转化率会增大,B不正确;温度升高,正、逆反应速率都增大,C错误;增大反应物Pb2+的浓度,平衡向正方应方向移动,Cr2O72-的物质的量会减小,D不正确。
 其余部分不难通过计算与分析完成.
其余部分不难通过计算与分析完成.