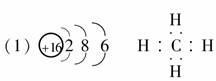15.(13分)A、B、C、D、E、F是原子序数依次增大的六种常见元素,其性质如下:
|
元素 |
性质 |
|
A |
单质在C2中燃烧可生成AC和AC2两种气体 |
|
D |
原子的最外层电子与其最内层电子数相同 |
|
E |
单质在C2中燃烧的产物可使品红溶液褪色 |
|
F |
与C元素形成的化合物F3C4具有磁性 |
请回答下列问题:
(1)F元素在周期表中的位置是____________;AC2的电子式为__________。
(2)D单质在空气中燃烧的化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)元素C与元素E相比,非金属性较强的是________(用元素符号表示),能证明这一结论的事实是________________________。
(4)A、B、C形成的10电子氢化物中,热稳定性最好的是________(写化学式);B、C的氢化物分子结合H+能力较强的是________(写化学式),用离子方程式加以说明______________________________。
[答案] (1)第4周期Ⅷ族  (2)2Mg+O22MgO,3Mg+N2Mg3N2,2Mg+CO22MgO+C
(2)2Mg+O22MgO,3Mg+N2Mg3N2,2Mg+CO22MgO+C
(3)O 氧的氢化物比硫的氢化物稳定(或S+O2SO2)
(4)H2O NH3 NH3+H3O+===NH4++H2O
13.(12分)下表列出了A-R九种元素在周期表中的位置:
|
主族 |
|
|
|
|
|
|
|
|
|
周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
二 |
|
|
E |
|
|
F |
|
|
|
三 |
A |
C |
D |
|
|
|
G |
R |
|
四 |
B |
|
|
|
|
|
H |
|
(1)D、E、R的元素符号分别为________、________、________,其中化学性质最不活泼的是________。
(2)G、H两种元素的最高价氧化物对应的水化物中,酸性最强的是________。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为__________。
(4)F元素氢化物的化学式是________,该氢化物在常温下跟B发生反应的化学方程式是________________________________________________________________________。
(5)A、G两种元素的最高价氧化物对应的水化物发生反应的化学方程式是________________________________。
(6)G元素和H元素、A元素和B元素原子的核电荷数之差分别是____________。
[答案] (1)Al B Ar Ar
(2)HClO4 (3)K、Na、Mg (4)H2O
2K+2H2O===2KOH+O2↑
(5)NaOH+HClO4===NaClO4+H2O
(6)18、8