10. 下列有关实验操作、现 象和解释或结
象和解释或结 论都正确的是
论都正确的是
|
选项 |
实验操作 |
现象 |
解释或结论 |
|
A |
过量的Fe粉中加入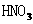 ,充分反应后,滴入KSCN溶液 ,充分反应后,滴入KSCN溶液 |
溶液呈红色 |
稀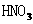 将Fe氧化为 将Fe氧化为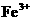 |
|
B |
Agl沉淀中滴入稀KCl溶液 |
有白色沉淀出现 |
AgCl比Agl更难溶 |
 C C |
Al箔插入稀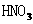 中 中 |
无现象 |
Al箔表面被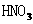 氧化,形成致密的氧化膜 氧化,形成致密的氧化膜 |
|
D |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上 |
试纸变蓝色 |
浓氨水呈碱性 |
[答案]D
[解析]本题综合考查化学实验 以及元素化合物的相关知识。
以及元素化合物的相关知识。
A选项,铁粉过量应该生成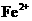 ,不会有红色出现;B选项AgCl溶解度比Agl大;C选项Al箔插入浓
,不会有红色出现;B选项AgCl溶解度比Agl大;C选项Al箔插入浓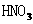 中才会形成致密的氧化膜钝化。
中才会形成致密的氧化膜钝化。
27.[14分]某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
|
温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度(×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是___________。
A.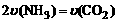 B.密闭容器中总压强不变
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:__________________________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量______(填“增加”、“减小”或“不变”)。
④氨基甲酸铵分解反应的焓变△H____0,熵变△S___0(填>、<或=)。
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
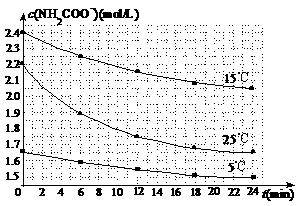
⑤计算25℃时,0-6min氨基甲酸铵水解反应的平均速率___________________________。
⑥根据图中信息,如何说明水解反应速率随温度升高而增大:_______________________。
解析:本题是一道考查化学反应速率概念及其计算,化学平衡、化学平衡常数的概念及其计算,
以及判断反应的焓变、熵变等相关知识的试题。试题设置的情景是学生并不熟悉的实验室探究
氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定,且测定的数据以图表形式
呈现。要求考生利用图表、进行数据分析判断,吸收、提取有效信息,突出了化学信息运用能
力的考查。同时,对于作为化学的基本技能之一的化学计算,渗透在相关的知识块之中,强调
计算的实用性以及认识、解决问题的综合性。
⑴ ①根据“同边异,异边同,量相当”原则,A.不能表示正逆反应速率相等,所以不能依据A判断该分解反应已经达到化学平衡状态;(NH2COONH4)为固体物质,(NH2COONH4)分解反应为一扩大气体体积的反应,由此可以判断,随着反应的进行密闭容器中总压强增大,所以,依据“B.达到平衡时密闭容器中总压强不变”,可以判断该分解反应已经达到化学平衡状态;同理,恒容条件下,随着反应的进行,则密度增大,依据“C.密闭容器中混合气体的密度不变”,可以判断该分解反应已经达到化学平衡状态;由于反应物(NH2COONH4)是固体物质,所以密闭容器中NH3的体积分数始终不变,为2/3。因此不能依据D判断该分解反应已经达到化学平衡状态。
②可将25℃的平衡总浓度4.8×10-3mol·L-1转化为NH3和CO2的平衡浓度;根据反应 NH2COONH4(s) 2NH3(g)+CO2(g)。可知平衡时NH3的体积分数为1/3,CO2 的体积分数为1/3。
2NH3(g)+CO2(g)。可知平衡时NH3的体积分数为1/3,CO2 的体积分数为1/3。
所以,25.0℃时的平衡浓度:c(NH3) = 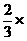 4.8×10-3mol·L-1, c(CO2) =
4.8×10-3mol·L-1, c(CO2) = 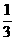 ×4.8×10-3mol·L-1 ;
×4.8×10-3mol·L-1 ;
则
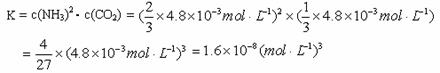
③恒温下压缩容器体积,平衡会向逆反应方向移动,氨基甲酸铵固体的质量增加。
④由于氨基甲酸铵固体分解反应是扩大气体体积的反应,根据表中实验测得不同温度下的
平衡数据分析可知,升高温度时,平衡总压强(kPa)增大,平衡气体总浓度(×10-3mol/L)增大,反应是正向移动,正反应为吸热反应,焓变△H>0 。氨基甲酸铵固体分解为气体,体系混乱度增大,熵变△S>0。
⑵ ⑤根据图中25℃曲线,可查得0-6min氨基甲酸铵的变化浓度数值 ,由此可计出此时段的平均反应速率:
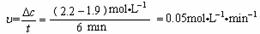
⑥将图中25℃曲线和15℃曲线进行比较,由比较可以看到25.0℃时反应物的起始浓度较
小,但0-6 min时的曲线斜率比15.0℃时的曲线斜率大,可以说明25.0℃时反应物氨基甲酸铵的平均速率比15.0℃时的平均速率大。由此可以推断氨基甲酸铵水解反应速率随温度升高而增大
答案:
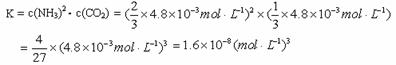 (1)①BC;
(1)①BC;
②
③ 增加;
④ >
>。
(2)⑤  ;
;
⑥ 25.0℃时反应物的起始浓度较小,但0-6 min的平均反应速率(曲线的斜率)仍比15.0℃时大。
13.海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
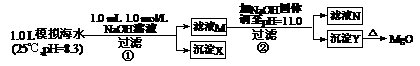
|
模拟海水中的 离子浓度(mol/L) |
Na+ |
Mg2+ |
Ca2+ |
Cl― |
 |
|
0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
解析:这是一道新颖的计算型分析推断题,命题者通过精心选择,以从模拟海水中制备MgO的实验方案为背景,结合考查有关溶度积的概念及计算,把一个具体情景与教材的知识内容有机结合起来。要求考生定量地分析发生的反应,溶液中存在的离子,推断沉淀是否产生,从而得出正确的结论。计算强调了实用性以及认识、解决问题的综合性,体现了新课程的特色。
⑴ 步骤①,从题给的条件,可知n(NaOH ) = 0.001mol,[即n(OH―) = 0.001mol]。依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001mol NaOH时,OH― 恰好与HCO3―完全反应:OH―+HCO3―= CO32-+H2O,生成0.001mol CO32―。由于Ksp(CaCO3) << Ksp(MgCO3),生成的CO32―与水中的Ca2+反应生成CaCO3 沉淀Ca2++ CO32- = CaCO3↓。所以沉淀物X为CaCO3,A选项正确。
⑵ 由于CO32―只有0.001mol,反应生成CaCO3 所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010 mol·L-1。滤液M中同时存在着Ca2+和Mg2+,选项B错误。
⑶步骤②,当滤液M中加入NaOH 固体,调至pH=11(即pOH = 3)时,此时滤液中c(OH―) = 1×10-3 mol·L-1 。则
Q[Ca(OH)2]=c(Ca2+)×(10-3)2 = 0.010×(10-3)2 = 10-8 <Ksp[Ca(OH)2],无Ca(OH)2生成。
Q[Mg(OH)2]= c(Mg2+)×(10-3)2 = 0.050×(10-3)2 = 5×10-8 > Ksp[Mg(OH)2],有Mg(OH)2沉淀生成。
又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+。C选项错误。
⑷步骤②中若改为加入4.2 g NaOH固体,则n(NaOH)=0.105mol,与0.05mol Mg2+反应:
Mg2++ 2 OH-= Mg(OH)2↓,生成0.05 mol Mg(OH)2,剩余0.005 mol OH―。
由于Q[Ca(OH)2]=c(Ca2+)×(OH―)2 = 0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀,D选项错误。.
答案:A
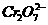 可通过下列反应转化成铬黄
可通过下列反应转化成铬黄 :
: +2
+2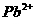 (aq)+
(aq)+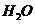 (l)
(l) 2
2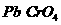 (s)+2
(s)+2 (aq) ΔH< 0
(aq) ΔH< 0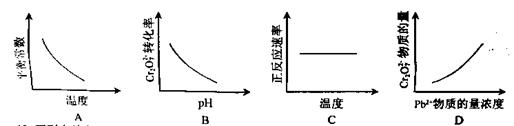
 大,B错;温度升高平衡不能往哪个方向移动,正逆反应速率均增大,C错;增加
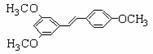
大,B错;温度升高平衡不能往哪个方向移动,正逆反应速率均增大,C错;增加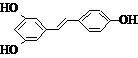 )属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:
)属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线: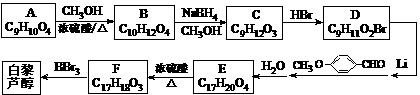
 。
。 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:_______________________________________________________________。
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:_______________________________________________________________。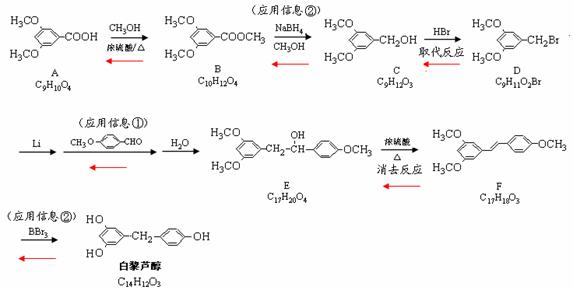
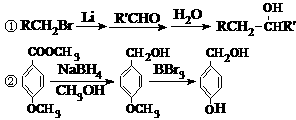
 ⑵ C→D的反应类型是取代反应;E→F的反应类型是消去反应。
⑵ C→D的反应类型是取代反应;E→F的反应类型是消去反应。 ⑶ 根据确定的化合物A的结构简式:可以知道,其1H核磁共振谱(H-NMR)
⑶ 根据确定的化合物A的结构简式:可以知道,其1H核磁共振谱(H-NMR)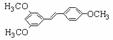
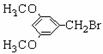
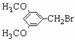 ⑸ D的结构简式为:E的结构简式为:
⑸ D的结构简式为:E的结构简式为: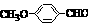 的同分异构体有三种:
的同分异构体有三种:
 (6)。
(6)。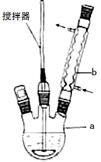 [15分]二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下:
[15分]二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下: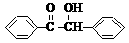 +2FeCl3
+2FeCl3
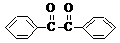 +2FeCl2+2HCl
+2FeCl2+2HCl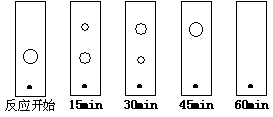 (5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是________。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是________。 >Fe3+>I2;还原性:
>Fe3+>I2;还原性: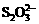 >I-
>I-
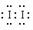 ⑴ 某加碘盐可能含有KIO3、KI、Mg2+、Fe3+,用蒸馏水溶解,并加稀盐酸酸化后将溶液分为3份。从第一份试液中滴加KSCN溶液后显红色,可知该加碘盐中含有Fe3+,反应: Fe3++ 3SCN-= Fe(SCN)3,Fe(SCN)呈血红色;从第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色,可知有碘生成。这是因为 由于“氧化性:
⑴ 某加碘盐可能含有KIO3、KI、Mg2+、Fe3+,用蒸馏水溶解,并加稀盐酸酸化后将溶液分为3份。从第一份试液中滴加KSCN溶液后显红色,可知该加碘盐中含有Fe3+,反应: Fe3++ 3SCN-= Fe(SCN)3,Fe(SCN)呈血红色;从第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色,可知有碘生成。这是因为 由于“氧化性: ;
; 。
。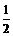 O2(g)
O2(g)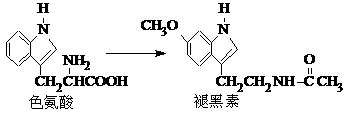
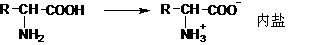
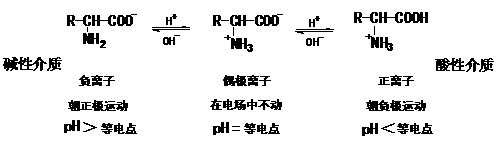 内盐分子中,既有带正电荷的部分,又有带负电荷的部分,所以又称两性离子.实验证明,在氨基酸晶体中,氨基酸是以两性离子的形式存在.氨基酸在水溶液中,形成如下的平衡体系:
内盐分子中,既有带正电荷的部分,又有带负电荷的部分,所以又称两性离子.实验证明,在氨基酸晶体中,氨基酸是以两性离子的形式存在.氨基酸在水溶液中,形成如下的平衡体系: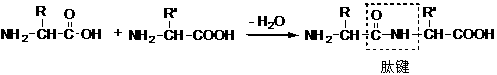

 已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。
已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。