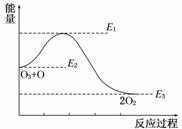
14.(18分)下表中的数据是破坏1 mol物质中的化学键时所消耗的能量(kJ):
|
物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
|
能量(kJ) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
根据上述数据回答(1)-(6)题.
(1)下列物质本身具有的能量最低的是________.
A.H2 B.Cl2
C.Br2 D.I2
(2)下列氢化物中,最稳定的是________.
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是________反应(填“吸热”或“放热”).
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,若消耗等物质的量的氢气时,放出或吸收热量最多的是________.
(5)若无上表中的数据,你能正确回答出问题(4)吗?
________.你的根据是_____________________________________________________.
(6)写出H2和Cl2反应的热化学方程式:_____________________________________
________________________________________________________________________.
解析:破坏1 mol物质时的化学键所消耗的能量与相同条件下由形成该物质的两原子形成1 mol该物质放出的能量相等,放出的能量越多,物质本身具有的能量越低,分子越稳定.
(1)生成1 mol H2时放出的能量最多,为436 kJ.
(2)生成1 mol HCl时放出的能量最多,为432 kJ.
(3)分别计算出三个反应放出的热量依次为:185 kJ、103 kJ和9 kJ.
答案:(1)A (2)A (3)放热 (4)Cl2
(5)能 生成物越稳定,放出的热量越多,在HX中,HCl最稳定
(6)H2(g)+Cl2(g)===2HCl(g);ΔH=-185 kJ/mol
11.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
|
化学键 |
H-H |
Cl-Cl |
H-Cl |
|
生成1 mol化学键时放出的能量(kJ/mol) |
436 |
243 |
431 |
则下列热化学方程式不正确的是( )
A.H2(g)+Cl2(g)===HCl(g)
ΔH=-91.5 kJ/mol
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol
C.H2(g)+Cl2(g)===HCl(g)
ΔH=+91.5 kJ/mol
D.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ/mol
解析:一个反应的反应热等于反应物的化学键键能之和-生成物的化学键键能之和.C项应为:H2(g)+Cl2(g)===HCl(g) ΔH=-91.5 kJ/mol.
答案:C
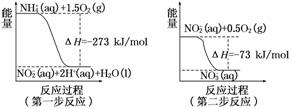
 ΔH=-346 kJ/mol
ΔH=-346 kJ/mol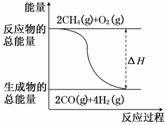 下列描述错误的是( )
下列描述错误的是( )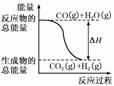 A.H2的燃烧热为241.8
kJ/mol
A.H2的燃烧热为241.8
kJ/mol