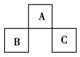
8.(2010年漳州质检)根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.061 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
[解析] 由主要化合价为+2价知,L、Q为第ⅡA族元素,又r(L)>r(Q),所以L为Mg元素,Q为Be元素;由主要化合价+3价及r(L)>r(M)>r(Q)知,M与L同周期且为第ⅢA族Al元素;由主要化合价为+6、-2价知,R为ⅥA族元素,又r(Q)>r(R)知,R为第三周期硫元素;由主要化合价为-2价,r(T)<r(R)知,T为第二周期第ⅥA族氧元素。A项中由于水分子间存在氢键,氢化物的沸点H2T>H2R(H2O>H2S),故A错误;B项中单质与盐酸反应速率,Mg>Be,故B项错误;C项中三氧化二铝是两性氧化物,故C正确;D项中Mg2+与S2-电子数不等,故D错误。
[答案] C
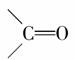 就是羰基),已知羰基硫分子中所有原子最外层均满足8电子稳定结构,结合元素周期表知识,下列有关说法正确的是( )
就是羰基),已知羰基硫分子中所有原子最外层均满足8电子稳定结构,结合元素周期表知识,下列有关说法正确的是( )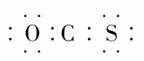
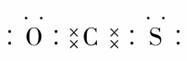 ,这表明羰基硫的结构与二氧化碳是相似的,其实就是CO2中的一个O原子被一个S原子代替。根据正确的电子式可知羰基硫分子结构中,
,这表明羰基硫的结构与二氧化碳是相似的,其实就是CO2中的一个O原子被一个S原子代替。根据正确的电子式可知羰基硫分子结构中,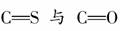 均是极性共价键,故选项D正确;B选项:羰基硫分子中有3个原子核,共有30(6+8+16)个电子,所以选项B错误;选项A:根据电子式可知C为+4价,O、S都是-2价,故选项A错误。
均是极性共价键,故选项D正确;B选项:羰基硫分子中有3个原子核,共有30(6+8+16)个电子,所以选项B错误;选项A:根据电子式可知C为+4价,O、S都是-2价,故选项A错误。 [解析] 对共价分子电子式的书写应注意:①原子最外层上未成键的电子也应全部标出;②弄清成键原子间的共用电子对数目。A项忽略了N原子最外层还有一对孤对电子,B项忽略了Cl原子最外层还有3对孤对电子,D项中C、O原子共用电子对标错。(错认为碳氧之间为单键,实际上为CO双键)
[解析] 对共价分子电子式的书写应注意:①原子最外层上未成键的电子也应全部标出;②弄清成键原子间的共用电子对数目。A项忽略了N原子最外层还有一对孤对电子,B项忽略了Cl原子最外层还有3对孤对电子,D项中C、O原子共用电子对标错。(错认为碳氧之间为单键,实际上为CO双键) H2O
H2O