15.(17分)(2009年广东高考)甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)HCOOH(l)+CH3OH(l) ΔH>0某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
|
组分 |
HCOOCH3 |
H2O |
HCOOH |
CH3OH |
|
物质的量/mol |
1.00 |
1.99 |
0.01 |
0.52 |
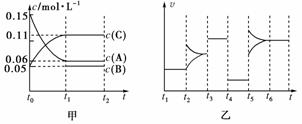
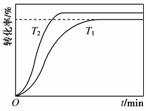
甲酸甲酯转化率在温度T1下随反应时间(t)的变化见下图:
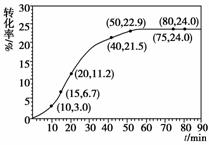
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
|
反应时间 |
|
|
|
|
|
|
|
|
范围/min |
0-5 |
10-15 |
20-25 |
30-35 |
40-45 |
50-55 |
75-80 |
|
平均反应速率/ |
|
|
|
|
|
|
|
|
(10-3 mol·min-1) |
1.9 |
7.4 |
7.8 |
4.4 |
1.6 |
0.8 |
0.0 |
请计算15-20 min范围内甲酸甲酯的减少量为______mol,甲酸甲酯的平均反应速率为__________mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应速率在不同阶段的变化规律及其原因:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)上述反应的平衡常数表达式为:
K=,则该反应在温度T1下的K值为______。
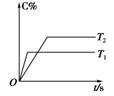
(4)其他条件不变,仅改变温度为T2(T2大于T1),画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
[解析] (1)由图中数据可以看出15-20 min内甲酸甲酯转化率提高了4.5%,利用转化率和速率的计算式计算。
(2)表格中平均反应速率的数据显示反应速率先增大后减小,因该反应是吸热反应排除温度升高的影响,则只能是反应体系中的某物质对该反应起到催化剂作用,而起始反应物中HCOOH的量很小,只能是其具有催化作用造成的。
(3)同一混合体系中各物质的浓度之比与物质的量之比相等,故可将平衡时刻各物质的物质的量代入平衡常数计算公式求算。
(4)注意该反应是吸热反应,T2>T1,温度升高,既能加快反应速率,又能缩短达到平衡的时间,提高转化率。
[答案] (1)0.045 9.0×10-3
(2)该反应中甲酸具有催化作用。①反应初期:虽然甲酸甲酯量较大,但甲酸量很小,催化效果不明显,反应速率较慢;②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大;③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使正反应速率逐渐减小,直至达到平衡状态 (3)0.14
(4)
14.(15分)在体积为1 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),反应焓变为ΔH,其化学平衡常数K和温度T的关系如下表:
|
T/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的ΔH______0。(填“>”或“<”)
(2)能判断该反应是否达到化学平衡状态的依据是______。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
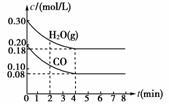
(3)若上述反应以CO和水蒸气为起始反应物,在T ℃时CO和H2O(g)的浓度变化如图所示,则0-4 min的平均反应速率v(CO2)=______mol/(L·min),T=______℃。
[解析] (1)由表格中温度与化学平衡常数的关系可知,温度越高,化学平衡常数(K)越大,即升高温度,平衡向正反应方向移动,故正反应为吸热反应,ΔH>0。(2)反应前后混合气体的总物质的量不变,所以压强在反应过程中始终不变。
(3)v(CO2)==0.03 mol/(L·min)。4 min时,c(H2O)=0.18 mol/L,c(CO)=0.08 mol/L,c(H2)=0.12 mol/L,c(CO2)=0.12 mol/L,计算化学平衡常数K=1,查表可知 K=1对应的温度为850 ℃。
[答案] (1)> (2)BC (3)0.03 850
11.等容积的四个密闭容器中,进行同样的可逆反应:
2A(g)+B(g)3C(g)+2D(g),起始时四个容器中A、B的物质的量分别如下表所示(mol),在相同条件下建立平衡,A或B的转化率大小关系为(多选)( )
|
|
甲 |
乙 |
丙 |
丁 |
|
A |
2 |
1 |
2 |
1 |
|
B |
1 |
1 |
2 |
2 |
A.A的转化率为:甲<丙<乙<丁
B.A的转化率为:甲<乙<丙<丁
C.B的转化率为:甲>乙>丙>丁
D.B的转化率为:甲>丙>乙>丁
[解析] 丙相当于乙缩小体积,增大压强,平衡向逆反应方向移动。丙中A、B转化率均小于乙;丙相当于在甲中再加入1 mol B,平衡右移,丙中A转化率大于甲中A转化率;丁相当于乙中再加入1 mol B,平衡右移,丁中A转化率大于乙中A转化率。故A的转化率大小关系为甲<丙<乙<丁,同理可得B的转化率的关系。
[答案] AD