摘要:已知反应:2CH3COCH3(l) CH3COCH2COH(CH3)2(l).取等量CH3COCH3.分别在0℃和20℃下.测得其转化分数随时间变化的关系曲线(Y-t)如下图所示.下列说法正确的是 A.b代表0℃下CH3COCH3的Y-t曲线 B.反应进行到20min末.H3COCH3的 C.升高温度可缩短反应达平衡的时间并能提高平衡转化率 D.从Y=0到Y=0.113.CH3COCH2COH(CH3)2的 解析:温度高反应速率就快.到达平衡的时间就短.由图像可与看出曲线b首先到达平衡.所以曲线b表示的是20℃时的Y-t曲线.A不正确,根据图像温度越高CH3COCH3转化的越少.说明升高温度平衡向逆反应方向进行.即正方应是放热反应.C不正确,当反应进行到反应进行到20min时.从图像中可以看出b曲线对应的转化分数高于a曲线对应的转化分数.这说明b曲线即20℃时对应的反应速率快.所以.B不正确,根据图像可以看出当反应进行到66min时a.b曲线对应的转化分数均相同.都是0.113.这说明此时生成的CH3COCH2COH(CH3)2一样多.所以从Y=0到Y=0.113.CH3COCH2COH(CH3)2的.即选项D正确. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_86717[举报]
 已知反应3A(g)+2B(g)?C(g)+4D(g);△H<0,如图中a、b表示一定条件下,D的体积分数随时间t的变化情况.若要使曲线b变为曲线a,可采取的措施是( )
已知反应3A(g)+2B(g)?C(g)+4D(g);△H<0,如图中a、b表示一定条件下,D的体积分数随时间t的变化情况.若要使曲线b变为曲线a,可采取的措施是( )①增大B的浓度
②升高反应温度
③缩小反应容器的体积加压
④加入催化剂.
查看习题详情和答案>>
已知反应C(s)+H2O(g)?CO(g)+H2(g)△H>0在一定温度下能自发进行,其原因为( )
| A、是吸热反应 | B、是熵减反应 | C、能量效应大于熵变效应 | D、熵变效应大于能量效应 |
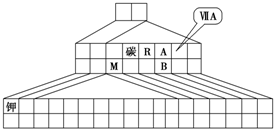 如图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.
如图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.回答下列问题:
(1)请在图中将过渡元素所在的位置涂黑.
(2)工业上用于冶炼M的化学方程式为
2Al2O3
4Al+3O2
| ||
2Al2O3
4Al+3O2
.
| ||
(3)M和R组成化合物MR的超细粉末被广泛应用于大规模集成电路生产等领域.其制取原理是用M的氧化物、R的单质与碳单质在高温下反应,已知反应中三种物质的物质的量之比为1:1:3,该反应的化学方程式为
Al2O3+N2+3C
2AlN+3CO
| ||
Al2O3+N2+3C
2AlN+3CO
,反应中
| ||
N2
N2
作氧化剂.(4)图中A、B两元素形成的离子B2A8-2中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.该离子可能具有的化学性质是
氧化性
氧化性
,依据是离子结构中存在-O-O-(部分氧元素呈-1价亦可)
离子结构中存在-O-O-(部分氧元素呈-1价亦可)
. 已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与P、T的关系如图,根据图示可以得出的正确结论是( )
已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与P、T的关系如图,根据图示可以得出的正确结论是( )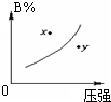 已知反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下达到平衡时B的体积分数(B%)与压强的关系如图所示,下列判断错误的是( )
已知反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下达到平衡时B的体积分数(B%)与压强的关系如图所示,下列判断错误的是( )