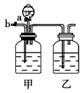
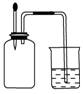
4.在如右图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状态喷出,最终几乎充满烧瓶。则a和b分别是表中的( )
|
|
a(干燥气体) |
b(液体) |
|
A |
NO2 |
H2O |
|
B |
NO |
4 mol·L-1 NaOH溶液 |
|
C |
Cl2 |
饱和NaCl溶液 |
|
D |
NH3 |
1 mol·L-1盐酸 |
[解析] A项能形成喷泉,但最终溶液充满烧瓶的,不符合题意;B、C项不能形成喷泉;D项能形成喷泉,且溶液最终充满烧瓶。
[答案] D
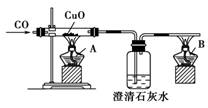
15.化学活动课上,三组学生用甲、乙两装置探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查过)。
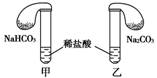
请回答:
(1)各组反应开始时,________装置中的气球体积先变大,该装置中反应的离子方程式是:________________________________________________________________________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
|
|
试剂用量 |
实验现象 (气球体积变化) |
分析原因 |
|
第①组 |
0.42
g NaHCO3 0.53 g Na2CO3 3 mL 4 mol/L盐酸 |
甲中气球与乙中气球的体积相等 |
甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V甲(CO2)= V乙(CO2) |
|
第②组 |
0.3
g NaHCO3 0.3 g Na2CO3 3 mL 4 mol/L盐酸 |
甲中气球比乙中气球的体积大 |
|
|
第③组 |
0.6
g NaHCO3 0.6 g Na2CO3 缓慢加入 3 mL 2 mol/L盐酸 |
甲中气球比乙中气球的体积大 |
|
|
片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
(用离子方程式表示)________________ |
[解析] (1)甲装置中反应的离子方程式为HCO3-+H+===CO2↑+H2O,乙装置中反应的离子方程式为CO32-+2H+===CO2↑+H2O,因此甲中反应快,气球体积先变大。
(2)与第①组相比较,②组中的NaHCO3和Na2CO3质量相对减小,而盐酸物质的量不变,因此②组中甲、乙装置中的盐酸均过量,NaHCO3和Na2CO3均完全反应产生CO2;由于Na2CO3和NaHCO3等质量且NaHCO3的相对分子质量小,因此n(NaHCO3)>n(Na2CO3),V甲(CO2)>V乙(CO2)。
与第②组相比较,③组中NaHCO3和Na2CO3的质量变为原来的2倍,而盐酸的物质的量减半,因此③组中甲、乙装置中的盐酸均不足量,甲中反应的离子方程式为HCO3-+H+===CO2↑+H2O,乙中反应的离子方程式为CO32-+H+===HCO3- HCO3-+H+===H2O+CO2↑,所以甲、乙装置中消耗样品的物质的量关系为n(NaHCO3)>n(Na2CO3),产生CO2的体积关系为V甲(CO2)>V乙(CO2)。
因为装置乙中存在反应:CO2+CO32-+H2O===2HCO3-,使最初产生的CO2被CO32-吸收,因此乙中的气球先变大后缩小。
[答案] (1)甲 HCO3-+H+===CO2↑+H2O
(2)②甲、乙盐酸均过量,n(NaHCO3)>n(Na2CO3),V甲(CO2)>V乙(CO2)
③甲、乙盐酸均不足量,消耗的n(NaHCO3)>n(Na2CO3),
V甲(CO2)>V乙(CO2) CO2+H2O+CO32-===2HCO3-
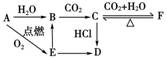
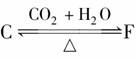 的转化关系,可知C为碳酸盐,F为酸式碳酸盐,再结合E是淡黄色粉末,应为Na2O2,则A、B、C、D、F分别为Na、NaOH、Na2CO3、NaCl、NaHCO3。
的转化关系,可知C为碳酸盐,F为酸式碳酸盐,再结合E是淡黄色粉末,应为Na2O2,则A、B、C、D、F分别为Na、NaOH、Na2CO3、NaCl、NaHCO3。