摘要:10.铜单质及其化合物在很多领域有重要用途.如金属铜用来制造电线电缆.五水硫酸铜可用作杀菌剂. (1)Cu位于元素周期表第ⅠB族.Cu2+的核外电子排布式为 . (2)右图是铜的某种氧化物的晶胞结构示意图.可确定该晶胞中阴离子的个数为 . (3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O.其结构示意图如下: 下列说法正确的是 . A.在上述结构示意图中.所有氧原子都采用sp3杂化 B.在上述结构示意图中.存在配位键.共价键和离子键 C.胆矾是分子晶体.分子间存在氢键 D.胆矾中的水在不同温度下会分步失去 (4)往硫酸铜溶液中加入过量氨水.可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的空间构型都是三角锥形.但NF3不易与Cu2+形成配离子.其原因是 . (5)Cu2O的熔点比Cu2S的 .请解释原因 . [解析] (1)电子排布为结构化学中的重点.特别是24号.29号等存在半满和全满状态的元素.Cu2+应先写出Cu原子的电子排布.然后从外向内失去2个电子. (2)对O2-个数的计算.面上的按算.顶点上按算.棱上按算.体心按1个算.可得O2-个数为:×8+×2+×4+1=4(个). (3)H2O中氧原子采用sp3杂化.SO42-中的氧不是.CuSO4应是离子晶体.不是分子晶体. (4)NH3中的N原子的孤对电子提供电子.Cu2+提供空轨道.形成配位键.而NF3中N原子的孤对电子被F元素吸引. (5)离子晶体中.离子键越短.离子键越强.离子化合物熔点越高. [答案] (1)1s22s22p63s23p63d9或[Ar]3d9 BD (4)F的电负性比N大.N-F成键电子对向F偏移.导致NF3中N原子核对其孤对电子的吸引能力增强.难以形成配位键.故NF3不易与Cu2+形成配离子 (5)高 Cu2O与Cu2S相比.阳离子相同.阴离子所带电荷也相同.但O2-的半径比S2-小.所以Cu2O的晶格能更大.熔点更高
网址:http://m.1010jiajiao.com/timu3_id_86583[举报]
 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.(1)超细铜粉的某制备方法如下:
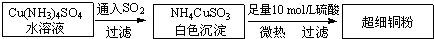
①[Cu(NH3)4]SO4中所含的化学键有
共价键、离子键、配位键
共价键、离子键、配位键
,N、O、S三种元素的第一电离能大小顺序为:N
N
>O
O
>S
S
.(填元素符号)②NH4CuSO3中的金属阳离子的核外电子排布式为:
1S22S22P63S23P63d10或[Ar]3d10
1S22S22P63S23P63d10或[Ar]3d10
.③NH3分子中N原子的杂化方式为:
SP3杂化
SP3杂化
.④SO42-离子的空间构型为
正四面体型
正四面体型
.(2)氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀.
①出上述制备CuCl的离子方程式:
2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-
| ||
2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-
.
| ||
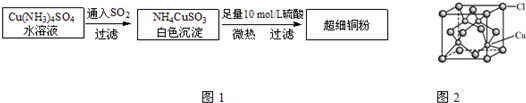
②CuCl的晶胞结构如上图所示,其中Cl原子的配位数为
4
4
.③CuCl的熔点比CuO的熔点
低
低
.(填“高”或“低”)铜单质及其化合物在很多领域有重要的用途.如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和CuCl2都是重要的化工原料,常用作颜料、防腐剂和消毒剂等.
Ⅰ.超细铜粉的某制备方法如图1:
(1)N、O、S三种元素的第一电离能由大到小顺序为
(2)化合物NH4CuSO3中,金属阳离子的核外电子排布式为
(3)化合物Cu(NH3)4SO4中,N原子的杂化方式为
Ⅱ.氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀.
(4)写出上述制备CuCl的离子方程式
(5)CuCl的晶胞结构如图2所示,其中Cl原子的配位数为
(6)CuCl的熔点比CuO的熔点
查看习题详情和答案>>
Ⅰ.超细铜粉的某制备方法如图1:

(1)N、O、S三种元素的第一电离能由大到小顺序为
N>O>S
N>O>S
.(2)化合物NH4CuSO3中,金属阳离子的核外电子排布式为
1S22S22P63S23P63d10
1S22S22P63S23P63d10
.(3)化合物Cu(NH3)4SO4中,N原子的杂化方式为
SP3杂化
SP3杂化
,SO42-的空间构型为正四面体
正四面体
.Ⅱ.氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀.
(4)写出上述制备CuCl的离子方程式
2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-
| ||
2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-
.
| ||
(5)CuCl的晶胞结构如图2所示,其中Cl原子的配位数为
4
4
.(6)CuCl的熔点比CuO的熔点
低
低
(选填“高”或“低”).铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下:

(1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为:
(2)SO42-中硫原子的杂化轨道类型是
(3)某反应在超细铜粉做催化剂作用下生成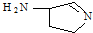 ,则分子中σ键与π键之比为
,则分子中σ键与π键之比为
(4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)NH4CuSO3中的金属阳离子的核外电子排布式为
(6)铜的某氯化物的晶胞结构如图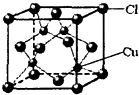 所示,该化合物的化学式为
所示,该化合物的化学式为
查看习题详情和答案>>

(1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为:
N>O>S
N>O>S
.(2)SO42-中硫原子的杂化轨道类型是
sp3
sp3
:写出一种与SO42-互为等电子体的分子CCl4
CCl4
.(3)某反应在超细铜粉做催化剂作用下生成
 ,则分子中σ键与π键之比为
,则分子中σ键与π键之比为14:1
14:1
(4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有
ACE
ACE
.(填字母)A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)NH4CuSO3中的金属阳离子的核外电子排布式为
1S22S22P63S23P63d10或[Ar]3d10
1S22S22P63S23P63d10或[Ar]3d10
.(6)铜的某氯化物的晶胞结构如图
 所示,该化合物的化学式为
所示,该化合物的化学式为CuCl
CuCl
. (2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
(2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.(1)Cu位于元素周期表第I B族.Cu2+的核外电子排布式为
[Ar]3d9或1s22s22p63s23p63d9
[Ar]3d9或1s22s22p63s23p63d9
.(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为
4
4
.(3)胆矾CuSO4?5H2O可写成[Cu(H2O4)]SO4?H2O,其结构示意图如下:

下列说法正确的是
ABD
ABD
(填字母).A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键.)
F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键.)
.(5)Cu2O的熔点比Cu2S的
高
高
(填“高”或“低”),请解释原因Cu2O与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高
Cu2O与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高
.铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
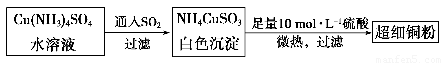
①NH4CuSO3中金属阳离子的核外电子排布式为______。N、O、S三种元素的第一电离能大小顺序为_______________________(填元素符号)。
②SO42-的空间构型为________。
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因______________________;在该晶体中存在的化学键的种类有_____________。
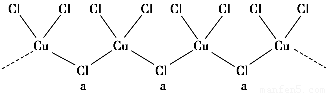
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为________。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为____________。
用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为__________pm,阿伏加德罗常数的值为________[已知Ar(Cu)=63.6]。
查看习题详情和答案>>